17. Покажите, как рассчитывается абсолютная энтропия
твердых, жидких веществ и их паров. Постулат планка.
Постулат Планка: энтропия
индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0 =
0.
Постулат Планка справедлив только для индивидуальных веществ,
кристаллы которых идеально построены (в кристаллической решетке все узлы заняты
молекулами или атомами, правильно чередующимися и закономерно
ориентированными). Такие кристаллы называются идеальными твердыми телами. Реальные кристаллы не являются
таковыми, так как их кристаллическая решетка построена не идеально.
В соответствии с постулатом Планка уравнение для идеального
твёрдого тела примет вид:![]() =
= 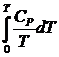
Значение теплоемкости до 0 К находят путем экстраполяции по
уравнению Дебая, либо с помощью эмпирических приемов. Если минимальную
температуру, при которой определено значение теплоемкости, обозначить Т*, то можно определить значение
коэффициента a’ в уравнении Дебая, приравняв выражение
для теплоемкости твердого тела по закону Т – кубов и выражение для теплоемкости
в виде степенной функции (I,15), считая, что при Т*
они равны:![]()
Принимая во внимание, что в приведенном уравнении
известны все величины, кроме коэффициента a’,
его легко определить. Тогда интеграл можно разложить
на два:![]()
![]() =
= 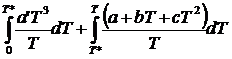
При переходе в жидкое состояние при
нормальной температуре плавления энтропия возрастает на величину приведенной
теплоты плавления. Нагреванию жидкости отвечает увеличение энтропии,
вычисляемое по уравнению (II, 25), причем в подынтегральную функцию входит теплоемкость
жидкости:![]()
![]() =
= 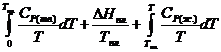 (II,27)
(II,27)
Испарение жидкости при постоянном давлении
(например, при Р = ![]() =
= 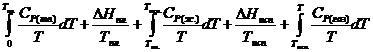 (II,28)
(II,28)
Когда вещество в твердом состоянии имеет
не одну, а две или более модификации, в правой части уравнения (II,26) добавятся соответствующие члены -
прирост энтропии при переходе первой модификации во вторую, прирост энтропии
при нагревании второй модификации и т. д.
18.Выведите ур-ие энергии Гельмгольца, объясните ее физ. смысл. Какие
параметры для энергии Гельмгольца являются естественными.
Работа процесса в общем случае, как это уже говорилось, зависит от
пути процесса. Работа неравновесного процесса меньше, чем работа равновесного
процесса, протекающего между теми же начальным и конечным состояниями системы: δW = dQ – dU £ TdS – dU (III, 1)
В случае равновесного процесса: dW = dWравн. = TdS – dU (III, 2)
Для неравновесного процесса: dW < TdS – dU (III, 3)
Сравнивая уравнения (III, 2) и (III, 3), получаем: dWравн.
> dW
Таким образом, работа равновесного процесса максимальна.
Максимальная работа не зависит от пути, а определяется лишь
начальным и конечным состояниями системы. Так, при S = const (равновесный адиабатный процесс) dW = –dU и Wмакс. = U1 – U2 (III, 4)
т. е.
величина макс. работы определяется изменением внутр.
энергии с-мы.
Интегрируя при постоянной Т уравнение
(III, 1а), получаем:
Wмакс. =
T (S2 – S1) –
(U2 – U1) или Wмакс. =
(U1 – TS1) – (U2 –
TS2) (III, 6)
Выражения, стоящие в скобках, являются функциями состояния
системы. Введя в уравнение (III, 6) обозначение F º U –
TS (III,
7)
получаем (при T = const) Wмакс. = F1 – F2 =
–DF (III, 8)
где F –
функция состояния,
называемая энергией Гельмгольца (А). Таким образом, максимальная работа
при изохорно-изотермических равновесных процессах равна убыли энергии
Гельмгольца системы.
Переписав уравнение (III, 3) в виде U = F + TS
можно рассматривать внутреннюю энергию, как состоящую из двух
частей – свободной энергии F и связанной
энергии TS.
Свободная энергия,
которую система отдает вовне при T =
const, может превратиться в работу (равновесные
процессы). Связанная энергия – при изменении системы, если Т = const, переходит только в
теплоту.
Полный дифференциал функции F можно получить, дифференцируя уравнение (III, 7):
dF º dU – TdS – SdT (III, 9)
Сопоставив это уравнение с уравнениями (III, 2) и (III, 3), получим в общем виде:
dF £
-SdT – dW (III, 10)
Откуда при Т = const
(dF)T £ –dW (III, 11)
или
F2 –
Fl = DF <
-W;
Fl – F2 > W (III,
12)
Выражение (III, 12) отражает уже известное нам положение, что работа
неравновесного процесса меньше работы равновесного процесса.
Если при равновесном процессе совершается только работа расширения
(dW = PdV),
то из уравнения (III, 10) получаем:
dF = -SdT – PdV (III, 13)
Это выражение является полным дифференциалом функции F при переменных V и Т.
Полагая T = const и V = const, а также при
условии отсутствия всех видов работы (dW = 0), получаем из уравнения (III, 10):
(![]() F)V, T £ 0 (III, 13а)
F)V, T £ 0 (III, 13а)
т. е., энергия
Гельмгольца системы, находящейся при постоянных V и Т не изменяется при
равновесных процессах, при неравновесных процессах ее значение убывает.
Свойства энергии Гельмгольца позволяют судить о том, находится ли
данная система в равновесии или нет. В последнем случае направление
неравновесного процесса определяется убылью энергии Гельмгольца при постоянных
температуре и объеме системы.
Условия, которым должны удовлетворять процессы, для того чтобы по
изменениям величины F можно было
судить о направлении этих процессов - это условие постоянства объёма и температуры.
Энергия Гельмгольца, являясь производным понятием по отношению к энтропии,
представляет собой практически более удобный критерий направления процессов,
чем энтропия.
Изложенные соображения могут быть выражены следующим положением: энергия
Гельмгольца системы, находящейся при постоянных объёме и температуре,
уменьшается при неравновесных (самопроизвольных) процессах. Когда она достигает
минимального значения, совместимого с данными V и Т, система приходит в
равновесное состояние.
18. Ур-ие энергии Гиббса.
Представим элементарную работу как сумму
работы расширения и других видов работы: ![]() dW = PdV
+ dW' (III, 14)
dW = PdV
+ dW' (III, 14)
где dW' –
сумма элементарных работ
всех видов, кроме работы расширения. Мы назовем эту величину элементарной полезной работой, а
величину W' – полезной работой. Из
уравнений (III,
11) и (III, 1) получаем:
dW' £ TdS – dU – PdV (III, 15)
Отсюда можно найти величину W', получаемую при переходе системы из
состояния 1 в состояние 2, интегрируя это уравнение в соответствующих пределах
при постоянных температуре и давлении:
Сгруппировав все величины, относящиеся к одному состоянию,
получим:
W' £ (U1 – TS1 + PV1) – (U2 –
TS2 + PV2) (III,
16)
Обозначим через G выражения, стоящие в скобках правой части уравнения, которые
являются функциями состояния, т. е.
G º U + PV – TS º
H – TS (III,
17)
Тогда уравнение (III, 16) можно записать следующим образом:
W' £ G1 –
G2 = -DG (III, 18)
Так как DG не зависит от пути процесса, то, при условии постоянства P и Т,
для равновесных процессов W'
будет максимально:
W'макс. = G1 – G2 = –DG (III, 19)
где G –
функция состояния,
определяемая равенством (III, 17) и называемая энергией
Гиббса. Таким образом, максимальная полезная работа при
изобарно-изотермических процессах равна убыли энергии Гиббса.
Для получения полного дифференциала функции G при переменных P и Т дифференцируем уравнение (III, 17): dG = dU – Т dS – SdT + PdV + VdP
Так как dU £ TdS –
PdV – dW',
то dG £ -SdT + VdP – dW' (III,
20)
Из этого уравнения при постоянных Т и P получаем уравнение
(III, 18) в
дифференциальной форме.
При отсутствии всех видов работы, кроме работы расширения (dW' = 0), в общем случае: dG £
-SdT
+ VdP (III,
21)
а для равновесных процессов
dG = -SdT
+ VdP (III,
22)
Полагая T = const и P = const, а также при
условии отсутствия всех видов работы, кроме работы расширения (dW’ = 0), получаем из уравнения (III, 21):
(![]() G) T,Р £ 0 (III, 22а)
G) T,Р £ 0 (III, 22а)
Энергия
Гиббса системы при постоянных давлении
и температуре уменьшается при неравновесных (самопроизвольных)
процессах, при равновесии её значение остаётся постоянным. Очевидно,
равновесное состояние системы при данных P
и Т соответствует минимуму
энергии Гиббса.
20.
Выведите ур-ие для расчета изменения энергии Гиббса
при смешении идеальных газов. Парадокс Гиббса.
Допустим, что равновесная
газовая смесь содержит i индивидуальных веществ.
Из определения энергии Гиббса
(III, 17) следует: G = U + PV – TS
Зависимость внутренней
энергии 1 моль индивидуального i-ого вещества от температуры: ![]() . Интегрируем
. Интегрируем ![]() или
или ![]()
где ![]() - внутренняя энергия 1 моль i-ого вещества при 0 К. Если в смеси этого вещества содержится
- внутренняя энергия 1 моль i-ого вещества при 0 К. Если в смеси этого вещества содержится
![]() моль:
моль: ![]() (III, 39)
(III, 39)
Исходя из ур-ия
Менделеева-Клапейрона, запишем в виде:![]()
Из уравнения (II, 21)
для 1 моль идеального газа следует:
![]() Положим
Положим ![]() 1 атм
и
1 атм
и ![]() , тогда
, тогда
![]() или
или ![]() (III, 41),
(III, 41),
где ![]() - стандартная (так как относится к
- стандартная (так как относится к ![]() = 1 атм.) энтропия
1 моль идеального газа при 1 К,
которая также называется энтропийной постоянной идеального газа:
= 1 атм.) энтропия
1 моль идеального газа при 1 К,
которая также называется энтропийной постоянной идеального газа: ![]() ,
,
где ![]() - относительное давление. Стоящие под знаком логарифма
величины
- относительное давление. Стоящие под знаком логарифма
величины ![]() и
и ![]() - безразмерные.
- безразмерные.
![]() (III, 42),
(III, 42),
где ![]() - относительное парциальное давление i-ого компонента.
- относительное парциальное давление i-ого компонента.
![]() (III, 43)
(III, 43)
Подставим все:![]() (III, 44)
(III, 44)
Первые пять слагаемых в этом
уравнении зависят от природы индивидуального
i-ого вещества и температуры, но не зависят от состава смеси и давления.
Алгебраическую сумму этих пяти слагаемых, стоящих в скобках, обозначим через ![]() . Тогда
. Тогда
![]()
![]()
![]()
Величина ![]() называется химическим потенциалом индивидуального i-ого вещества, а величина
называется химическим потенциалом индивидуального i-ого вещества, а величина ![]() - стандартным
химическим потенциалом (при
- стандартным
химическим потенциалом (при ![]() =1).
=1).
Так как для идеальной газовой
смеси ![]() и
и ![]() , то уравнение
, то уравнение
(III, 46)
можно привести к виду:
![]() (III, 48),
(III, 48),
где ![]()
21.
Характеристические функции.
Термодинамические функции – свойства системы:
внутреннюю энергию U,
энтальпию H, энтропию S, энергию Гельмгольца F, энергию Гиббса G. Каждое из этих свойств
можно представить в виде функции различных переменных, определяющих состояние
системы. Однако в системах, состоящих из индивидуальных веществ, каждому из них
можно приписать две переменные, которые можно считать «естественными» для той или
иной функции.
В этом случае функция становится характеристической,
т.к. через каждую из этих функций и ее производные в явном виде выражаются
любые термодинамические свойства системы-
любое измеримое свойство макроскопической равновесной системы.
Так, внутренняя энергия является характеристической
функцией при переменных объеме V и
энтропии S, т.е.
![]()
Если для равновесного процесса, когда в системе
совершается только работа расширения, записать формулу объединенного первого и
второго законов термодинамики (II,17а) относительно dU,
то получим
![]()
Из чего следует, что
![]() и
и ![]() (III, 23а)
(III, 23а)
Таким
образом, производная внутренней энергии по энтропии при постоянном объеме равна
температуре, а производная внутренней энергии по объему при постоянной энтропии
равна давлению со знаком минус. При любых других переменных нельзя получить
такие простые выражения свойств системы через производные внутренней энергии.
Следовательно, для нее объем V и энтропия S являются естественными
переменными.
Другими характеристическими функциями являются:
![]()
![]()
![]()
Запишем выражения для полных дифференциалов
названных функций и частных
производных этих функций по их естественным переменным:
![]()
![]() (III, 24)
(III, 24)![]()
![]() (III, 24а)
(III, 24а)
![]() (III, 25)
(III, 25)![]()
![]() (III, 25а)
(III, 25а)
![]() (III, 26)
(III, 26)![]()
![]() (III, 26а)
(III, 26а)
Выражения (III, 23) - (III,
26) называются
фундаментальными (каноническими) уравнениями состояния. Они образуют замкнутую
группу, в которой две пары переменных – температура Т и энтропия S являются параметрами,
связанными с теплотой. С другой стороны, давление Р и объем V связаны с работой.
22.
Общие критерии равновесия систем, в которых протекают обратимые и необратимые
процессы.
Функции ![]() ,
, ![]() ,
, ![]() ,
, ![]() или их производные,
выражая в явном виде любое измеримое термодинамическое свойство, дают, таким
образом, полную термодинамическую характеристику системы. Поэтому указанные
функции называют характеристическими. Замена для данной функции естественных
переменных на любые другие вполне возможна, но при этом лишает ее свойств
характеристической функции.
или их производные,
выражая в явном виде любое измеримое термодинамическое свойство, дают, таким
образом, полную термодинамическую характеристику системы. Поэтому указанные
функции называют характеристическими. Замена для данной функции естественных
переменных на любые другие вполне возможна, но при этом лишает ее свойств
характеристической функции.
![]()
![]() и
и ![]()
![]()
![]() (III, 24)
(III, 24)![]()
![]()
![]() (III, 25)
(III, 25)![]()
![]()
![]() (III, 26)
(III, 26)![]()
![]()
Любая из этих функций может быть использована для
того, чтобы сформулировать как критерий самопроизвольности процесса, так и
критерий равновесия для систем, рассматриваемых при постоянстве естественных
для этих функций переменных.
Для функций, имеющих размерность энергии (U,H,F и G),
критерием самопроизвольности является их убыль, критерием равновесия –
минимальное значение
Для энтропии (S), которую также можно рассматривать как
характеристическую функцию переменных U и V или
H и P, соответствующими критериями будут возрастание
энтропии и ее максимальное значение.
На протяжении веков было принято считать, что законы природы просты. Действительно,
законы механики, гравитации, электромагнетизма допускают простые формулировки и
могут быть точно представлены всего лишь несколькими уравнениями. Помимо
простоты природа склонна также к «оптимизации», т.е. экономии. Явления природы
часто происходят так, что некоторая физическая величина достигает своего
минимального или максимального значения, или, если воспользоваться
собирательным термином, достигает экстремального значения.
В
равновесной термодинамике также реализуются принципы экстремумов. Приближение к равновесию
происходит так, что термодинамические потенциалы достигают своего экстремального
значения.
23.
Химический потенциал. Ур-ие химического потенциала
газа.
![]() (III, 45)
(III, 45)
или, если ввести обозначение
![]() (III, 46)
(III, 46)
то выражение (III, 45)
можно окончательно представить в таком виде:
![]() (III, 47)
(III, 47)
Величина ![]() называется химическим потенциалом индивидуального i-ого вещества, а величина
называется химическим потенциалом индивидуального i-ого вещества, а величина ![]() - стандартным
химическим потенциалом (при
- стандартным
химическим потенциалом (при ![]() =1).
=1).
![]()
![]()
Если ![]() есть функция
только температуры, то
есть функция
только температуры, то ![]() зависит не только
от температуры, но и давления.
зависит не только
от температуры, но и давления.
Подставив значения ![]() из уравнений (III, 46)
и (III, 48) в (III, 47), то соответственно
получим:
из уравнений (III, 46)
и (III, 48) в (III, 47), то соответственно
получим:
![]() (III, 49)
(III, 49)
и
![]() (III, 50)
(III, 50)
Чтобы прояснить смысл понятия
«химический потенциал», продифференцируем выражение (III, 49)
как произведение при постоянных Р и Т:
![]() (III, 51)
(III, 51)
Легко показать, что при
постоянных Р и Т второе слагаемое ![]() (
(![]() зависит только от температуры).
зависит только от температуры).
Тогда для системы переменного
состава
![]() (III, 52)
(III, 52)
Примем постоянным число молей
всех компонентов смеси, кроме i-ого
компонента, тогда
![]() (III, 53)
(III, 53)
или
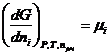 (III, 54)
(III, 54)
Из определения химического
потенциала как частной производной вытекает следующее. Если при постоянных
температуре Т и давлении Р
к бесконечно большому количеству смеси (раствора) определенного состава
добавить один моль какого-нибудь компонента, то химический потенциал будет
равен приросту энергии Гиббса.
Сказанное выше позволяет
определить химический потенциал как энергию Гиббса, приходящуюся на один моль
компонента в смеси или, иными словами, парциальную молярную энергию Гиббса.
Полный дифференциал энергии Гиббса в соответствии с (III, 26)
и (III, 53) запишется следующим образом:
![]() (III, 55)
(III, 55)
Из определения химического
потенциала как частной производной вытекает следующее. Если при постоянных
температуре Т и давлении Р
к бесконечно большому количеству смеси (раствора) определенного состава
добавить один моль какого-нибудь компонента, то химический потенциал будет
равен приросту энергии Гиббса.
Сказанное выше позволяет
определить химический потенциал как энергию Гиббса, приходящуюся на один моль
компонента в смеси или, иными словами, парциальную молярную энергию Гиббса.
Химический потенциал является
частной производной по количеству i-ого
компонента от любой характеристической функции G,F,U и H при постоянном
количестве остальных индивидуальных веществ в системе и постоянстве
соответствующих независимых переменных. ![]() (III, 55)
(III, 55)
![]() (III, 56)
(III, 56)
![]() (III, 57)
(III, 57)
![]() (III, 58)
(III, 58)
Из уравнений (III, 55)
– (III, 58) вытекает:
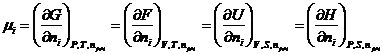
Необходимо отметить, что
химический потенциал является интенсивным свойством системы.
Химический потенциал для
одного моля чистого вещества в состоянии идеального газа при любых температуре Т и давлении Р можно рассчитать по уравнению: ![]() (III, 59)
(III, 59)
Вообще химический потенциал
чистого вещества – это его мольная энергия Гиббса: ![]() , где
, где ![]() - энергия Гиббса 1 моля чистого вещества.
- энергия Гиббса 1 моля чистого вещества.
24. Условия равновесия в однокомпонентной двухфазной
системе
В системе, состоящей из нескольких фаз чистого вещества,
находящихся в равновесии, возможны переходы вещества из одной фазы в другую.
Такие переходы называются фазовыми
переходами или превращениями агрегатных состояний.
Рассмотрим
равновесный переход одного моля вещества из одной фазы (1) в другую (2),
совершающийся при постоянных давлении и температуре. Энергии Гиббса (G1 и G2) моля вещества в фазах 1 и 2 равны (условие равновесия).
Следовательно: G2 =
G1 (IV, 1)
Напишем уравнения (III, 13б) полных дифференциалов для энергии Гиббса одного моля
чистого вещества в двух равновесных фазах 1 и 2:
dG1 = V1dP – S1dT
dG2 = V2dP – S2dT (IV, 2)
Вычитая верхнее уравнение из нижнего, получим:
dG2 – dG1 = (V2 – V1) dP – (S2 –
S1) dT
Изменения P и Т здесь были не независимыми, а такими,
при которых сохранялось равновесие между фазами 1 и 2. Таким образом, между P и
Т сохранялась функциональная связь, соответствующая фазовому равновесию.
Поэтому, если G1 = G2 (равновесие при давлении P и температуре Т), то G1 + dG1 = G2 + dG2 (равновесие при давлении P +
dP и
температуре T
+ dT),
значит, dGl = dG2 или dG2 –
dG1 = 0. Следовательно
(V2 – V1)dP – (S2 – S1)dT = 0
или
![]() (IV, 3)
(IV, 3)
Взаимное превращение фаз рассматривалось как равновесное и
изотермическое, поэтому:
S2 – S1 = DS = ![]() =
= ![]() =
= ![]() (IV, 4)
(IV, 4)
Здесь ![]() – теплота фазового превращения, поглощаемая при
переходе моля вещества из фазы 1 в фазу 2; V2 – V1 – разность мольных объёмов двух фаз.
– теплота фазового превращения, поглощаемая при
переходе моля вещества из фазы 1 в фазу 2; V2 – V1 – разность мольных объёмов двух фаз.
Из уравнений (IV, 3) и (IV, 4) получим:
![]() (IV, 5)
(IV, 5)
Уравнение (IV, 5) называется уравнением
Клапейрона-Клаузиуса и является общим термодинамическим
уравнением, приложимым ко всем фазовым переходам
чистых веществ, т.е. к превращениям агрегатных состояний.
При превращении одной фазы в другую такие свойства как удельный
или мольный объём, внутренняя энергия и энтропия одного грамма или одного моля
вещества изменяются скачкообразно. Однако отсюда не следует, что внутренняя
энергия всей двухфазной системы не является в этом случае непрерывной функцией
её состояния. В самом деле, система, состоявшая в начале процесса, например, из
некоторого количества льда при 0°С и 1 атм, при
постоянном давлении и подведении теплоты превращается в двухфазную систему лед-жидкая вода, в которой по мере поглощения теплоты масса
льда постепенно и непрерывно убывает, а масса воды растет. Поэтому также
постепенно и непрерывно изменяются такие свойства системы в целом как
внутренняя энергия, энтальпия, энтропия и др.