40.
Выведите уравнение изобары. Его практическое применение.
Уравнение
изобары химической реакции для стандартных (или любых других условий) условий
можно получить, объединяя уравнение Гиббса — Гельмгольца:
∆G0T=∆H0T+T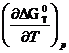
с уравнением изотермы изотермы реакции:
∆G0T=-RT lnKx
Из этих двух уравнений получим:
RT2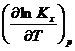 =-RT lnKx+ RT lnKx + ∆H0T
=-RT lnKx+ RT lnKx + ∆H0T
Из этого уравнения изобара химической реакции
будет иметь такой вид:
RT2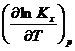 =
=![]()
Где ∆H0T — тепловой эффект химической
реакции, Дж/моль.
Последнее уравнение можно использовать в
дифференциальной форме для расчета теплового эффекта или Кх
с помощью ЭВМ или аналитически по интегральным уравнениям. Их молено получить
с помощью метода неопределенлого или определенного
интегрирования уравнения.
Неопределенное интегрирование. Вначале разделим переменные в уравнении RT2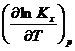 =
=![]()
dlnKx=![]()
Для неширокого интервала изменения температуры
можно принять тепловой эффект постоянным (∆H0T = const) и тогда уравнение легко проинтегрировать:
![]() +lnC
+lnC
После завершения интегрирования получим:
lnKx=-![]() +lnC
+lnC
Это уравнение решается графически, если его представить
в координатах lnKx=K(1/T)
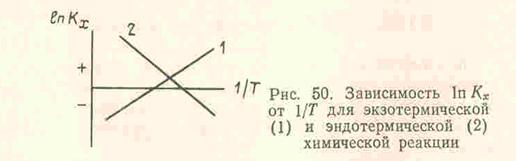
По тангенсу угла наклона прямой к оси абсцисс
можно рассчитать теплоту реакции tgφ=-∆H0T/R, а на оси ординат прямая отсекает отрезок,
равный In С. В экспоненциальной форме уравнение принимает такой вид:
Kx=C![]()
Это уравнение графически изображается экспонентой.
Определенное интегрирование. Для неширокого интервала температуры, при условии независимости ∆H0T от температуры, уравнение RT2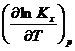 =
=![]()
можно проинтегрировать методом определенного
интегрирования;
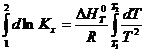 откуда получим выражение:
откуда получим выражение:
ln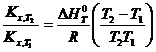
С помощью этого уравнения можно рассчитать ∆H0T по экспериментальным значениям Kx при различных температурах или можно рассчитать Kx,T2 если известны значения теплового эффекта реакции и Kx,T1
Общая температурная зависимость константы
равновесия от температуры.
В широком интервале изменения температурь] тепловой
эффект химической реакции зависит от температуры, которую можно определить по
формуле Кирхгофа;
![]() ∆Cp
∆Cp
I Теплоемкости чаще
всего в литературе определяют по степенному ряду типа: СР=а+bТ+сТ2
или согласно Матвееву по уравнению: СР=а+bТ+сТ2 +dT3+e/T2+f/T
Для химической реакции ∑νiAi=∑ν’iA’i разность теплоемкостей продуктов реакции и исходных веществ определится
по формуле: ∆СР=∆а+∆bТ+∆сТ2
Подставим этот степенной ряд в формулу Кирхгофа:
![]() ∆а+∆bТ+∆сТ2
∆а+∆bТ+∆сТ2
Разделяя переменные и интегрируя в интервале от
0 до Т К:
∆H0T=∆H00+∆аT+∆b/2Т2+∆с/3Т3
где ∆H00—эмпирическая константа интегрирования, которая
в данном случае не имеет физического смысла. Она приобретает четкое физическое
содержание, если для теплоемкостей веществ используется теоретическое
уравнение зависимости СР=Ср(Т). Подставим
это выражение в уравнение изобары, получим:
![]() =(∆H00+∆аT+∆b/2Т2+∆с/3Т3)/RT2
=(∆H00+∆аT+∆b/2Т2+∆с/3Т3)/RT2
Разделяя переменные в этом уравнении и беря йеодределен-ный интеграл, получим такую зависимость Кх от Т:
lnKx=-∆H00/ RT+∆аlnT/R+∆bТ/R2+∆с/3RТ2+I/R
где /—константа интегрирования. Ее величину
рассчитывают по опытным данным или теоретически с помощью тепловой теоремы
Нернста.
Практическое применение.
Изобара химической реакции позволяет
рассчитывать константы равновесия для разных температур.
39. Понятие о химическом сродстве. Что такое
стандартное химическое сродство?
В смеси один вещества активно реагируют между
собой (например, олефины и О2), а другие при обычных условиях не
взаимодействуют друг с другом — N2 и О2,
N2 и Н2. Из этого следует, что способность молекул различных веществ
химически взаимодействовать друг с другом связана с какими-то особыми силами,
которые химики назвали химическим сродством. Следовательно, химическое сродство
определяется, как способность веществ подвергаться химическим превращениям или
химическому взаимодействию с образованием продуктов реакции.
Вначале
за меру химического сродства предлагали принимать скорость химической реакции.
Однако скорость химической реакции при одних и тех же условиях можно было
изменять путем воздействия на вещества
катализаторами разной природы. Это приводило к
неопределенности при определении химического сродства. Поэтому скорость химической I реакции не может
быть мерой химического сродства.
I Ю. Томсен (1853) и П. Бертло (1867) предложили за меру г химического сродства
принимать тепловой эффект химической
реакции, которая проходит самопроизвольного выделением теплоты
(экзотермические процессы). Однако работами Д. И. Менделеева было показано, что
этот принцип не обладает общностью. Дело в том, что, во-первых, некоторые
реакции проходят самопроизвольно, но с поглощением энергии в форме теплоты при
обычных температурах. Во-вторых,
все реакции являются
обратимыми. Еще Бекетов показал, что одни и те
же реакции при одних условиях проходят с выделением теплоты, а при
других —с поглощением, как например, реакции гидрирования этилена.
При обычных температурах эта реакция идет в
прямом направлении с выделением теплоты, а при высоких температурах — в
обратном направлении с поглощением теплоты. Следовательно, теплоту реакции
также нельзя использовать при обычных условиях в качестве меры химического
сродства.
Правильное направление в определении меры химического сродства было
намечено работами Дж. В. Гиббса и Г. Гельмгольца,который
был развит Вант-Гоффом, который предложил в качестве меры химического сродства использовать максимальную работу
химического процесса. Максимальная и максимально-полезная работы определяются по выражениям:
∆А=-W и ∆G=-W’
Эти величины являются интегральными и не зависят
от способа проведения химического процесса, а зависят только от начального и
конечного состояния системы. Учитывая, что;
∆GT= ∆HT-T∆ST,
Bеличина ∆GT будет равна тепловому эффекту реакции при T→0
Следовательно, сродство по Вант-Гоффу
и Томсену—Бертло будут
совпадать, если T∆ST =0 при Т=0, а
∆GT= ∆HT
Для стандартных условий химическое сродство
можно рассчитывать, по формуле: ∆GT0= ∆HT0-T∆ST0
Стандартные условия характеризуют, что энергия
Гиббса рассчитывается при давлении вещества в системе, равном Р= = 1 атм; 101,3 кПа; 1,013-105 Па.
Знак изменения энергии Гиббса характеризует
направление самопроизвольного или несамопроизвольного
протекания процесса при данных условиях, а равенство (д∆GT°)р,Т=0 определяет
равновесное состояние в смеси химических веществ, между которыми возможно
химическое взаимодействие. Равновесие имеет динамический характер, то есть при равновесии υпр=
υобр.
Химическое сродство можно рассчитывать по
изменению энергии Гиббса, по изотермам, изохорам и изобарам химической реакции.
С его помощью и закона действующих масс можно рассчитывать равновесный состав
химического процесса.
Стандартное химическое сродство определяется
соотношением:
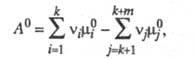
где![]() - стандартные хим. потенциалы соотв. реагентов и продуктов (см. Стандартное
состояние). Стандартное X. с. связано со стандартным изменением энергии Гиббса
- стандартные хим. потенциалы соотв. реагентов и продуктов (см. Стандартное
состояние). Стандартное X. с. связано со стандартным изменением энергии Гиббса ![]() и константой равновесия р-ции
К:
и константой равновесия р-ции
К:
![]()
38. Выведите уравнение изотермы химической реакции,
протекающей в идеальной газовой смеси.
Изменение энергии Гиббса в ходе реакции при
изменении числа прореагировавших эквивалентов участников реакции определится
по выражениям:
![]()
![]() =RTlnX∑νii-RTlnKx,
=RTlnX∑νii-RTlnKx,
где Рi-парциальные давления, а Р∑νii определяется по соотношению:
Р∑νii=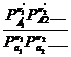 Поставив первое выражение во второе,получим:
Поставив первое выражение во второе,получим:
![]() =RTlnР∑νii-RTlnKр,Предположим, что масса веществ в резервуаре настолько велика, что
превращение исходных веществ и продуктов реакдии в
количестве, равном эквиваленту, не изменяет величину Х. Тогда
производную от энергии Гиббса можно проинтегрировать в данном пределе изменения
состояния системы:
=RTlnР∑νii-RTlnKр,Предположим, что масса веществ в резервуаре настолько велика, что
превращение исходных веществ и продуктов реакдии в
количестве, равном эквиваленту, не изменяет величину Х. Тогда
производную от энергии Гиббса можно проинтегрировать в данном пределе изменения
состояния системы:![]()
Завершая интегрирование, получим:
G2-G1=![]() (λ2- λ1)
(λ2- λ1)
G2-G1= (RTlnР∑νii-RTlnКр) (λ2- λ1)
Так
как в идеальном газе парциальные давления исходных компонентов равны единице, то:
G2-G1= RTlnKр (λ2- λ1)
Если
в ходе реакции превращается только один эквивалент веществ,тогда:
λ2- λ1=1, и получим уравнение:
∆ G = -RTlnKр или RTlnKр= WT
37.
Докажите графически тепловую теорему Нернста.
Тепловая теорема Нернста
Изменение энергии Гиббса определяется для
стандартных условий согласно выражению:
∆GT0= ∆HT0-T∆ST0При температуре абсолютного нуля справедлив принцип Бертло, когда значения ∆GT0 и ∆HT0 равны между собой, то
есть:
∆G00=∆H00 при Т=0 К.
Это равенство выполняется вследствие того, что
кривые, определяющие зависимость ∆GT0= G (Т) и ∆HT0=H(T), сближаются при понижении температуры
и совпадают между собой уже в окрестности абсолютного нуля и они имеют общую касательную.
На этом основании В. Нернст сформулировал теорему о тангенсе угла наклона
касательной к обеим кривым в такой форме: при температуре, стремящейся к
абсолютному нулю для реакций, протекающих между веществами в конденсированной
фазе, тепловой эффект равен изменению энергии Гиббса или изменению энергии
Гельмгольца, а производные от этих функций равны друг другу и равны нулю:
![]() =0.
=0.
Эта теорема доказывается экспериментально-графическим способом. Для
этого строят на графике по формуле Кирхгофа кривую зависимости теплового
эффекта от температуры ∆НТ°=Н(Т).
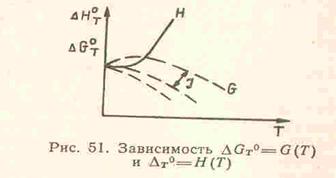
Затем подставляют формулу Кирхгофа в формулу ![]() и рассчитывают
изменение энергии Гиббса, задавая разные численные значения для константы
интегрирования J. На графике получена одна (сплошная) кривая для изменения
теплового эффекта реакции с изменением Т и несколько пунктирных кривых
для зависимости изменения энергии Гиббса от Т, которые отстоят друг от
друга на расстоянии, задаваемом константой J.
и рассчитывают
изменение энергии Гиббса, задавая разные численные значения для константы
интегрирования J. На графике получена одна (сплошная) кривая для изменения
теплового эффекта реакции с изменением Т и несколько пунктирных кривых
для зависимости изменения энергии Гиббса от Т, которые отстоят друг от
друга на расстоянии, задаваемом константой J.
Из семейства кривых для ∆GT0=G(T) реальной
является та, которая совпадает со сплошной кривой для зависимости ∆НТ°=Н(Т)
и идет совместно с ней параллельно оси абсцисс вплоть до T=0 К. Эта закономерность отражает независимость термических
свойств веществ вблизи абсолютного нуля и является утверждением, что с термодинамической точки зрения
абсолютный нуль недостижим. Вблизи абсолютного нуля термические свойства
рабочего тела перестают зависеть от температуры. Производные от теплового
эффекта и ∆GT°
вблизи абсолютного нуля при P=const
пo T
будут равны нулю. Далее, учитывая, что:
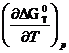 =-∆S0T и
=-∆S0T и 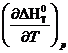 =∆Ср
=∆Ср
на основе тепловой теоремы Нернста можно
получить равенство нулю изменения энтропии и теплоемкости конденсированных
веществ при Т→0 К, то есть:
∆S0T =0 и Ср=0.
(11.11)
Для конденсированных систем эти величины слабо
зависят от Р и Т, поэтому индекс нулик можно не применять.
С помощью тепловой теоремы Нернста можно
определить численное значение константы интегрирования J при условии, что
T=0 К и реакция проходит между веществами, находящимися в
конденсированном состоянии. С этой целью уравнение:
∆GT0= ∆H00-T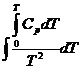 +JT
+JT
Продифференцируем по температуре при P=const,получим такое
выражение:
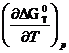 =
=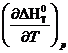 -
-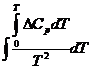 -
-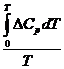 +J
+J
Устремим температуру к нулю Кельвина:
![]()
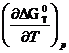 =
= ![]()
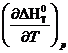 -
- ![]()
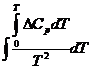 -
- ![]()
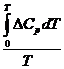 +
+ ![]() Jb
Jb
Применяя
к этому выражению тепловую теорему в форме соотношений ![]() =0 приходим к выводу, что все члены в нем равны
нулю при Т→-0, и следовательно, константа интегрирования для
указанных выше условий также будет равна нулю, то есть J=0.
=0 приходим к выводу, что все члены в нем равны
нулю при Т→-0, и следовательно, константа интегрирования для
указанных выше условий также будет равна нулю, то есть J=0.
Таким образом, для химической реакция,
протекающей между веществами в конденсированном состоянии, изменение энергии
Гиббса можно уже рассчитывать по уравнению, не содержащему константу
интегрирования:
∆GT0= ∆H00-T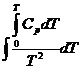
В этом уравнении в правой части содержатся
только термические и калорические величины ∆Hо° и СР
и не содержатся функции равновесия, то есть константа интегрирования J. Поэтому по уравнению можно рассчитать равновесие реакции между
конденсированными веществами только по термическим данным, не изучая опытно
химическое равновесие в такой системе. Подставляя в это уравнение изотерму химической
реакции, можно рассчитать уже константу равновесия.
36. Покажите какая связь существует между константами
равновесия химических реакций Кр ,
Кс ,Кх ,Кf , Кр0 ?
Реакции в газовой фазе, в общем случае, проходят
с изменением числа молей веществ, поэтому численные значения констант
равновесия зависят от тех параметров, через которые они Выражены, то есть:
Кс=![]()
Кр=![]()
Кх=![]()
Эти константы в общем случае не равны между
собой: Кс ≠КР ≠КХ.
Для идеальной газовой смеси веществ, участвующих в химической
реакции, связь между константами равновесия можно получить на основе перехода от одних единиц
измерения состава смеси к другим, используя законы Клапейрона—Менделеева
и Дальтона в такой форме:
Рi=сiRТ и Рi= хiР;при подстановке этих уравнений в Кр=![]() , получим:
, получим:
КР=ПсνiAi(RT)∑νi и КР=Кс(RT)∑νi
КР=ПХνiAiРνi и КР=КхРνi,
где для исходных веществ стехиометрические
коэффициенты берутся со знаком минус, а для продуктов реакции — со знаком
плюс; кроме того,
∑νi=- ν1- ν2-…+ ν’1+ ν’2+…
Численные значения
констант равновесия будут равны между собой только при условии, когда ∑νi = 0 или при условии проведения реакции в
конденсированной фазе. Тогда:
И КР(Т)=Кc(Т)=Кx(Р, Т).
Обращаем
внимание на то, что константы равновесия являются безразмерными величинами.
35. Выведите закон действующих масс для системы, в
которой реакция протекает в растворе.
Для реакций, протекающих в
растворах (жидких или твердых), в качестве параметра, измеряющего его свойства,
используют активность. Изменение химического потенциала общего типа
определяется по разности химических потенциалов продуктов реакции и исходных веществХимический
потенциал компонентов в растворе при Т=соnst рассчитывается по выражению:μi=RTln аi+ φi( T),где аi, —
активность i-го
вещества в смеси.. Для химической реакции общего вида ∑ υiАi=∑ υ’iА’i разность
химических потенциалов запишется в таком виде:∑μν=
-
ν1RTln аA1- ν1 φ 1( T)- ν2RTln аA2- ν2 φ 2( T)-…+ ν‘1RTln аA‘1+ν’1 φ’1( T)+ ν‘2RTln аA‘2- ν’2 φ’2( T)+…
∑μν= RTln а∑ν+ ∑ν φ( T), где
а∑ν=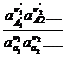 Выражение записано
для некоторого состояния веществ в растворе, удаленного от равновесия. После
достижения равновесия: ∑ν μ=0,
Выражение записано
для некоторого состояния веществ в растворе, удаленного от равновесия. После
достижения равновесия: ∑ν μ=0,
и из уравнения получим такое выражение:
ln а∑νравн= -∑ν φ(T)/ RT, где
знак «равн.» определяет равновесные значения
активностей.
где а∑ν —отношение
произведений активностей компонентов в растворе, которое представляется в таком
виде:
а∑ν=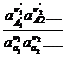
При постояннойТ в уравнение ln а∑ν= -∑ν μ0(T)/ RT можно ввести константу равновесия Ка
:
ln Ка= -∑ν φ(T)/ RT.
Сравнивая уравнения, получим;
ln Ка=ln а∑ν
Потенцируя это выражение, Получим закон
действующих масс в форме:
Ка=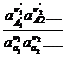 Если раствор при понижении концентрации веществ в нем
приобретает идеальные свойства, тогда аi=ci и закон действующих
масс приобретает обычную форму. Следовательно, Ка=
Кс при с→0
Если раствор при понижении концентрации веществ в нем
приобретает идеальные свойства, тогда аi=ci и закон действующих
масс приобретает обычную форму. Следовательно, Ка=
Кс при с→0
34. Кинетический и термодинамический выводы закона
действующих масс для реакции, протекающей в газовой фазе при низких давлениях.
Все химические реакции
одновременно протекают в 2 направлениях: в сторону образования продуктов
реакции (прямая реакция) и в сторону превращения продуктов в исходные вещества (обратная
реакция). Вследствие химической обратимости реакции не доходят до конца, так
как скорость реакции прямо пропорциональна концентрации, то с течением времени
скорость прямой реакции будет уменьшаться, а скорость обратной расти. Когда обе
скорости сравняются, наступит химическое равновесие. Химическое равновесие –
динамическое, характеризуется постоянством равновесных концентраций (или
парциальных давлений) всех участков реакции при постоянстве внешних условий и
минимальном значении энергии Гиббса или Гельмгольца.
Например, для реакции
синтеза иодида водорода Н2+I2↔2HI
скорости прямой и обратной реакции υпр=kпрсН2сI2; υобр=kобрс2HI.
При равновесии υпр= υобр, а концентрации становятся
равновесными (с’). Тогда kпрс’Н2с’I2= kобрс‘2HI или kпр/kобр= с‘2HI/
с’Н2с’I2, где kпр и kобр- константы скорости
соответственно прямой и обратной реакции.
Эти величины не зависят от
концентрации и при постоянной температуре являются постоянными. Поэтому их
отношение есть некая постоянная величина Кс, называемая константой
химического равновесия: Кс= kпр/kобр= с‘2HI/
с’Н2с’I2. В общем виде для реакции υаА+υвВ↔
υсС+ υdD
Кс=( с‘с)υс(с‘d)υd/( с‘a)υa(с‘B)υB,где с‘с
с‘D с‘A с‘B-равновесные
концентрации участников реакции. Это уравнение выражает закон действующих
масс: отношение произведения равновесных концентраций(давлений) продуктов
реакции, взятых в степенях ,равных их стехиометрическим коэффициентам, к такому
же произведению концентраций(давлений парциальных) исходных веществ при данной
температуре есть величина постоянная, называемая константой химического равновесия.
Химический потенциал компонентов в смеси при Р,
Т=соnst
рассчитывается по выражению:
μi=RTln Xi+ μ0i(P,
T)
где Xi, — мольная доля i-го вещества в смеси. Это произвольная (неравновесная)
величина. Для химической реакции общего вида ∑ υiАi=∑ υ’iА’i разность химических потенциалов запишется в
таком виде:
∑μν=
-
ν1RTln XA1- ν1 μ01(P, T)- ν2RTln XA2- ν2 μ02(P, T)-…+ ν‘1RTln XA‘1+ν’1 μ0’1(P, T)+ ν‘2RTln XA‘2-
ν’2 μ0’2(P, T)+…
∑μν= RTln X∑ν+ ∑ν μ0(P, T), где
X∑ν=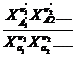
Выражение записано для некоторого состояния смеси
веществ, удаленного от равновесия. После достижения равновесия: ∑ν μ=0,
и из уравнения получим такое выражение:
ln X∑ν= -∑ν
μ0(P, T)/ RT,
где X∑ν —отношение произведений равновесных мольных
долей веществ в смеси, которая представляется в таком виде:
X∑ν=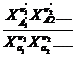
При постоянных Р иТ в
уравнение ln X∑ν= -∑ν μ0(P, T)/ RT можно ввести константу равновесия Кх
:
ln Кх= -∑ν μ0(P, T)/ RT.
Сравнивая уравнения, получим;
ln Кх=ln X∑ν
Потенцируя это выражение, Получим закон
действующих масс в форме:
Кх=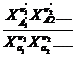
Константа равновесия Кх
зависит уже от Р и Т.
33. Условия равновесия в
химической системе. Химическая переменная. Какие методы вычисления ∆G0 реакции вам известны?
Химические реакции являются двухсторонними, то
есть они одновременно протекают как в сторону продуктов реакции, так и в
сторону образования исходных веществ со скоростями: υпр — прямой реакции и υобр — обратной реакции. В
начальных условиях эти скорости реакций не равны, а результирующая скорость
процесса будет равна разности скоростей реакций прямого и обратного
направления:υ= υпр- υобр
Реакция проходит в направлении достижения
равновесного состояния в системе, которое определяется как динамическое
равновесие. Для равновесия:
υ= 0 и υпр= υобр
Систему можно подвести к равновесию термодинамически обратимо, если в системе имеется сопротивление
типа проницаемой перегородки, или термодинамически
необратимо. В химической системе; можно выделить истинно равновесные смеси
веществ и системны с ложным равновесием. Истинное равновесие характеризуется тем,
что с изменением термодинамических параметров (Р, Т) на бесконечно малую величину
на такую же величину изменяется и равновесный состав смеси веществ. При
возвращении параметров до исходного значения равновесие также возвращается к
исходному состоянию. Это легко можно проиллюстрировать на примере реакции:
N2O4=2NО2.
При комнатной температуре эта смесь содержит в
равновесной смеси небольшую концентрацию N02 и смесь бесцветна. При
нагревании смеси при повышенной, но постоянной температуре, равновесие cдвигается вправо
и смесь приобретает желто-бурую окраску. Если смесь охладить до комнатной
температуры, то окраска смеси снова исчезает, то есть система возвращается к
исходному состоянию равновесия.
Ложное равновесие характеризуется тем, что при
малых воздействиях на смесь веществ в ней протекают конечные изменения. Так,
смесь, содержащая 2 объема Н2 и один объем О2, может
существовать длительное время без изменения и находится как бы в состоянии
равновесия. При внесении в такую смесь накаленной платиновой
Проволочки она реагирует со взрывом. Изменения в такой системе уже необратимы.
Изменения в равновесных химических системах
можно изучать с помощью термодинамических функций и, в частности, с помощью
энергий Гельмгольца и Гиббса. Для удобства изучения химических процессов
вводится понятие химической переменной или пробега реакций. Для этого
записываем общее выражение химического превращения веществ, учитывая, что взаимодействие
молекул друг с другом в смеси проходит в строго стехиометрических соотношениях
(закон Дальтона) в таком виде:
ν1А1+ ν2А2+…![]() ν’1А’1+ ν’2A’2+…
ν’1А’1+ ν’2A’2+…
где νi ν’i — стехиометрические коэффициенты исходных веществ
и продуктов реакции: Кс, КР,Кх
— константы равновесия. В термохимических и термодинамических уравнениях для
химических реакций принято стехиометрические коэффициенты исходных веществ
записывать со знаком минус, а продуктов реакции — со знаком плюс. В смеси
вещества реагируют между собой в строго эквивалентном количестве, что
определяется следующими соотношениями:
-![]() =-…=+
=-…=+![]()
где ![]() ,
, ![]() — число молей исходных веществ и продуктов реакции.
Эти соотношения можно представить в форме одной переменной и представить эти
соотношения в таком виде:
— число молей исходных веществ и продуктов реакции.
Эти соотношения можно представить в форме одной переменной и представить эти
соотношения в таком виде:
![]() dλ
dλ
Параметр λ называют химической
переменной или пробегом реакции, величина которого зависит от величины
числа моль веществ и величины стехиометрического коэффициента. Так, если в
химической смеси веществ одновременно может протекать несколько химических
реакций, то каждая из них будет характеризоваться своей химической переменной,
то есть λ1,
λ2, λ3 и т. д.
Ранее было показано, что состояние химически
неоднородной системы можно рассчитать с помощью энергии Гиббса по уравнению:
dG=-SdT+VdP-ν1d![]() -
ν2d
-
ν2d![]() -…+
ν’1d
-…+
ν’1d![]() +…
+…
Подставив в это уравнение значение химической
переменной,
получим:
dG=-SdT+VdP-ν1μ1d λ1- ν2μ2dλ2-…+ ν’1μ‘1d λ+…
При постоянных Р и Т уравнение сведется к
виду
dG=(∑μν) d λ, где
∑νμ= ν’1μ’1+ ν’2μ’2+…-ν1μ1- ν2μ2
Из уравнения
находится первая производная от
энергии Гиббса по химической переменной при Р, Т=соnst:
![]()
Это выражение определяет изменение энергии
Гиббса в зависимости от глубины протекания реакции, то есть от изменения числа
прореагировавших эквивалентов веществ, если реакция проходит на некотором
удалении от равновесия. Это выражение показывает, что: 1) смеcь веществ обладает разностью химических потенциалов
не равной нулю∑νμ≠0,
2)смесь идет к
равновесию термодинамически обратимо,
3)движущей силой
химической реакции является разность∑νμ≠0 . По
достижении равновесия энергия Гиббса не
меняется и тогда производная будет равна нулю:
![]() =0
=0
На основе этого равенства находим, что: ∑νμ =0.
Это равенство показывает, что равновесие в
химической системе характеризуется тем, что алгебраическая сумма химических
потенциалов, умноженная на стехиометрические коэффициенты, равна нулю. Это
есть общее условие равновесия в смеси химических веществ, между которыми
проходят реакции.
Для термодинамически
необратимого процесса, протекающего самопроизвольно, величина производной
будет меньше нуля:
![]() <0, и ∑νμ<0.
<0, и ∑νμ<0.
Это неравенство безусловно выполняется для
изолированной системы, в которой могут протекать только самопроизвольные
процессы. Аналогично можно получить критерии, определяющие состояние смеси
веществ в изолированной системе при постоянных объеме и температуре, то есть:
![]() =∑νμ,
=∑νμ,
![]() =0, ∑νμ=0.
=0, ∑νμ=0.
Методы вычисления ∆G0 реакции:
I.
По свойствам энергии образования
химических соединений при любой температуре: от свободной энергии
образования берем свободную энергию образования из справочника.
∆G0298=∑(νi∆G0)прод-∑(νi∆G0)исх
II.
Приближенный метод.
G=H- ТS
∆G=∆H+ Т∆S В стандартных условиях: ∆G°т=∆H°т - Т∆S°т ,
∆H°т ≈ ∆H°298 ∆S°т ≈ ∆S°298
∆G°298=∆H°298 - Т∆S°298
III. По уравнению Гиббса-Гельмгольца
∆G0=∆H0+ Т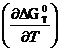
С0р=∆H0-∆аТlnT-∆bТ2/2
+∆сТ3/6+JT, J-константа интегрирования. Она не должна быть не
очень маленькой, не очень большой.
IV. Метод Чермена
∆G0т=А+ВТ,где А и В-коэффициенты, которые находятся
суммированием групповых составляющих, на которое разбивается данное химическое
соединение + поправки на образование колец и поправки на разветвление в
основной структуре молекулы. Для улучшения или точности метода коэффициенты А и
В дают для 2-х интервалов температут 300-600,
600-1500.