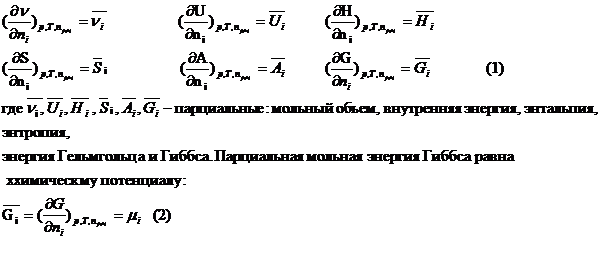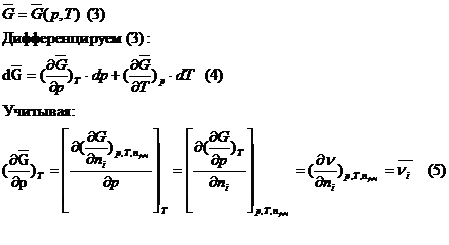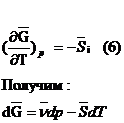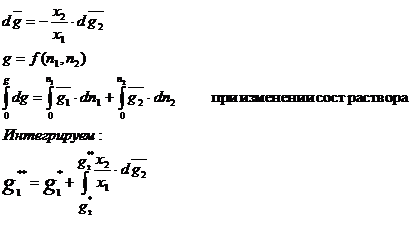49. Суммарная кривая изменения
потенциальной энергии взаимодействия двух молекул или других частиц от
расстояния между ними.
Потенциальную энергию можно представить в
форме суммы энергий притяжения молекул друг к другу под воздействием сил ориентационного,
индукционного и дисперсионного взаимодействия и энергии, развиваемой
силами отталкивания:
n,m - целые положительные числа, причем п < т ,
А и В - параметры потенциала, рассчитанные для данной пары
взаимодействующих молекул.
Если принять величзану
m= 12,
n = 6, тогда потенциал Леннард –Джонса записывают в форме :
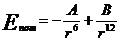 (4)
(4)
Знак минус определяет притяжение молекул, плюс - отталкивание. Эту формулу можно изобразить на графике в виде кривой потенциальной энергии.
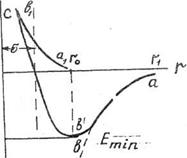
На рис. кривая ав соответствует энергии притяжения молекул, кривая  - отталкиванию молекул. Суммарная кривая изменения потенциальной энергии при сближении молекул определяется кривой авс. При сближении молекул, начиная от расстояния
- отталкиванию молекул. Суммарная кривая изменения потенциальной энергии при сближении молекул определяется кривой авс. При сближении молекул, начиная от расстояния  , может производиться работа в этой системе силами притяжения, которая идет на увеличение кинетической энергии. В точке "в" молекулы будут находиться на равновесном расстоянии друг от друга, когда силы отталкивания будут уравновешивать силы притяжения. Система из двух молекул на таком расстоянии будет обладать минимумом потенциальной энергии, то есть мин. избытком потенциальной энергии.
, может производиться работа в этой системе силами притяжения, которая идет на увеличение кинетической энергии. В точке "в" молекулы будут находиться на равновесном расстоянии друг от друга, когда силы отталкивания будут уравновешивать силы притяжения. Система из двух молекул на таком расстоянии будет обладать минимумом потенциальной энергии, то есть мин. избытком потенциальной энергии.
При дальнейшем сближении молекул, на расстояние 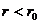 ,
,
уже будут преобладать силы отталкивания, что характеризуется левой восходящей ветвью кривой.
Численное
значение коэффициентов в уравнении (3) можно выразить через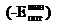 и равновесное расстояние
и равновесное расстояние 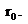 Минимум на потенциальной кривой характеризуется равенствами:
Минимум на потенциальной кривой характеризуется равенствами:
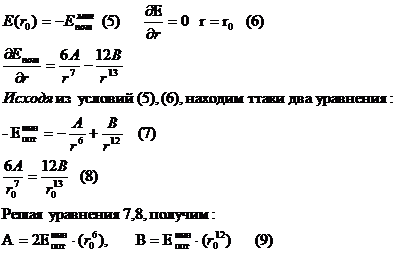
 Кривые потенциальной энергии используют при обьяснении
адсорбции и десорбции молекул
углеводородов.
Кривые потенциальной энергии используют при обьяснении
адсорбции и десорбции молекул
углеводородов.
50. Виды специфических взаимодействий
между молекулами.
Водородная связь определяется как средняя
по энергии ММВ. Она характеризуется энергией, изменяющейся в пределах 20-40 кДж/молъ, что определяется природой
молекул. Водородная связь создается, когда в молекуле присутствуют как
донорные, так и акцепторные центры. Акцептором электронов в молекулах является
протонизированный водород (H*), а донором электронов являются атомы с несвязанной парой
электронов (-ОН, - NН2,- SH и др.).
В настоящее время выделяют следующие типы водородных связей:
а) Внутримолекулярная водородная связь
возникает между протоном и атомом-донором электронов функциональной группы в
пределах одной и той же молекулы. Процесс возникновения внутримолекулярной водородной связи назхелацией.
б) По дублетному типу водородные связи
образуются при димеризации молекул кислородсодержащих соединений. Такие связи образуются при взаимодействии
двух карбоновых кислот.
в) Пространственно-решеточные водородные
связи создаются в структуре
низкомолекулярных спиртов, меркаптанов или в жидкостной воде. В
этих жидкостях образуются
пространственные фигуры, в которой вокруг центральной молекулы могут
располагаться 4, 5 или 6 других молекул полярного соединения. Так, в объеме
жидкой воды при обычных условиях могут создаваться пространственно-упакованные группы молекул в
форме тетраэдров, тригональных бипирамид или даже октаэдра.
г) Цепочечная водородная
связь образуется между атомами галогена в жидких галогенводородах, в которых протекают как бы процессы
полимеризации молекул НГ за счет
связывания молекул друг с другом водородной связью.
Ионно-молекулярное - близкое к электростатическому, имеет некоторые
черты донорно-акцентной связи.
В основе – эл-статическое, индукционное и дисп-ное взаимодействия.
Играет
большую роль в р-рах элементов в полярных р-рителях, где образуются сольваты. М/у ионом и неполярной молекулой в растворе – в основном
индукционное и дисп-ное взаимодействие. Если у неполярной молекулы есть легко
поляризуемые электроны, то образуется комплексы с переносом заряда.
51. Понятие о реактивном поле.
Реактивное поле возникает в смеси полярных
и неполярных молекул, например, таких как углеводороды и нафтеновые кислоты смолистые соединения и жидкие углеводороды и др. В
смесях нефтяных углеводородов полярные молекулы воздействуют полем определенной
симметрии (симметрия поля определяется симметрией вакантных молекулярных
орбиталей) и напряженности Н на молекулы
углеводородов. Это поле возбуждает молекулярные орбитали, содержащие
электроны, разделяя заряды, что обусловливает появление (наведение) диполя
такой же симметрии и, возможно, несколько меньшей напряженности поля H1. Молекула с индуцированным диполем в
свою очередь воздействует своим полем на полярную молекулу, изменяя ее
электромагнитное поле, то есть возбуждает в ней реактивное (ответное) поле.
Возникновение
реактивного поля приводит к повышению энергии взаимодействия двух частиц, что
отражается в создании прочных сольватных оболочек в смеси полярных и
неполярных жидкостей у молекул полярного типа. Создание прочных первичных
сольватных оболочек упрочняет структуру элементарных пространственных объединений
разнородных молекул, то есть полиэдров, что отражается в свойствах растворов
полярных и неполярных жидкостей.
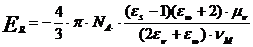
где знак минус определяет притяжение
молекул;
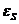 -
статическая электрическая
проницаемость;
-
статическая электрическая
проницаемость;
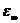 - диэлектрическая
проницаемость, обусловленная электронной и атомной поляризуемостью полярных
молекул;
- диэлектрическая
проницаемость, обусловленная электронной и атомной поляризуемостью полярных
молекул;
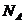 - число
Авогадро;
- число
Авогадро;
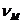 - объем, занимаемый I
молем полярного вещества в изотропной падкости;
- объем, занимаемый I
молем полярного вещества в изотропной падкости;
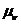 - дипольный момент;
- дипольный момент;
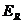 - энергия I
моля полярного вещества в растворе.
- энергия I
моля полярного вещества в растворе.
Из формулы видно, что величина энергии реактивного доля
возрастает с повышением дипольного момента и числа молекул в смеси и с
уменьшением мольного объема полярных молекул. При разделении смеси полярных и
неполярных молекул на составляющие ректификацией необходимо уменьшать величину
реактивного поля, а при экстракции, наоборот, повышать его величину.
52. Сущность физической, химической и физико - химической теорий образования растворов.
Химическая теория растворов развивалась Д.И.Менделеевым,
который рассматривал растворы как смеси непрочных
химических соединений молекул растворенного вещества с молекулами растворителя.
Эти представления основывались на экспериментальной зависимости плотности
водно-спиртовых растворов от состава и на зависимости первой
производной от плотности спиртового раствора по числу моль спирта
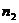 в зависимости от состава раствора.
в зависимости от состава раствора.
Развитием теории Д.И.Менделеева является полиэдрическая теория образования
растворов, согласно которой в жидкости из однородных и разнородных молекул
создаются элементарные пространственные группы-полиэдры. Однако химическая
теория не может объяснить механизм образования идеальных растворов, отклонения
в свойствах реальных растворов от свойств идеальных растворов и др.
Для объяснения свойств идеальных растворов
с изменением их состава била предложена физическая
теория (В.Ф.Алексеев - 1870--1880 гг.) и была проложена в
работах Вант-Гоффа, Аррениуса и др. Согласно этой теории, процесс растворения
одного вещества в другом является результатом простого распределения молекул по
объему тепловым движением, при этом между взаимодействующими молекулами
проявляются только слабые MМB. В результате простого перемешивания молекул веществ процесс растворения при создании идеальных растворов не
сопровождается тепловым эффектом. Идеальными свойствами обладают также
разбавленные растворы. Идеальными свойствами в любых пределах изменения концентрации
растворов обладают смеси веществ с близкими по
свойствам молекулами: н-гептан-н-гексан, оптические изомеры.
Общая теория растворов в настоящее время не создана,
хотя проводятся широкие научные исследования методами квантовой химии,
статистической термодинамики, кристаллохимии, различными физико-химическими
методами анализа Д.И.Менделеев указывал, что образование растворов может
рассматриваться с двух сторон: с физической и химической, и в растворах виднее,
чем где-либо, насколько эти стороны естествознания сближены между собою. В учении о растворах широко используются
представления о полиэдрической их структуре и развиваются аналитические методы,
связывающие структуру, состав и свойства растворов.
53. Полиэдрическое строение жидкостей и их растворов,
влияние изменения параметров на структуру жидкостей и растворов.
Структура жидкости определяется как способ
распределения молекул в ее объеме. Структуру чистых жидкостей в ближнем порядке , то есть на расстояниях двух радиусов от центральной
частицы, устанавливают с применением методов рассеяния рентгеновских лучей,
радиочастотной спектроскопии.
Впервые полиэдрическое строение в жидком
бензоле в 1915 г.
установил Дебай. В жидкой воде Берналом и Фаулером были установлены
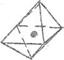
тетраэдрические образования, а также позже было предположено существование тригональных
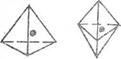
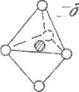
бипирамид и октаэдров (рис. 3D)
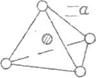
Рис. 30. Структура: тетраэдра - а, тригональной бипирамиды - б
и октаэдра – в
Полиэдром называют элементарную
пространственную группу молекул или атомов, созданную за счет МMB
(орбитального) молекул, располагающихся друг от друга на расстоянии радиуса и под углом, обеспечивающим
минимум энергии в состоянии полиэдра. Число молекул, которые окружают центральную
молекулу (ион) в жидкости (или твердом теле) и образуют первую координационную сферу, называют
координационным числом (к.ч.), а молекулы из координационной сферы называют лигандами. Каждый полиэдр характеризуется определенным к.ч., а состав и структура его определяются правилами
кристаллохимии.
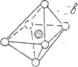
В жидкости полиэдры неустойчивы, они постоянно разрушаются и создаются, но
при этом сохраняются его среднестатистическая структура и состав. Несколько
соединенных между собою полиэдров создает ансамбль полиэдров ели кластер (рой частиц).
В
полиэдрах происходит такие непрерывная замена одних лигандов другими из
объема жидкости. Этот обмен проходит легко, если сила ММВ меньше кТ, то есть когда
тепловое движение оказывает большое влияние на структуру жидкости. Процесс
объединения однородных молекул в полиэдры, ансамбли полиэдров или кластеры называют ассоциацией.
Координационное число
полиэдров в чистых углеводородах (и полярных жидкостях) зависит от природы молекул
и температуры. С повышением температуры к.ч. центральных молекул в составе
полиэдров меняется по-разному. С повышением температуры к.ч. полиэдра для полярных
жидкостей типа воды растет с 4,4 при Т = I
293 К до 4,9 при Т = 373 К. Для неполярных жидкостей к.ч. снижается для н-пентана с
8,9 при Т = 213 К до 5,6 при Т = 303,2 К.
54.
Понятие об ассоциации и сольватации. Первичные и вторичные сольватные оболочки.
Положительная и отрицательная сольватация.
Газы, жидкости и
твердые вещества, растворяясь в жидкости, распределяются на молекулярном или ионном
уровне среди полиэдров растворителя.
При этом вначале происходит разрушение полиэдров жидкости, а затем молекулы
растворителя координируются вокруг молекулы или иона растворенного вещества.
Процесс обьединения однородных молекул в полиэдры,
ансамбли полиэдров и кластеры- наз. ассоциацией.
Процесс взаимодействия
молекул растворителя с ионами или молекулами растворенного вещества по предложению И.А.Каблухова (1987 г.) называют сольватацией,
а ион с сольватной оболочкой - сольватом.
Сольваты в объеме жидкости образуются за счет слабого, среднего и сильного
ММВ, которые включают силы Ван-дер-Ваальса, водородные связи, комплексы с переносом
заряда или химические связи.
Вокруг молекулы или иона в жидкости могут
создаваться ближайшая, то есть первая координационная сфера (в составе полиэдра),
а также вторая, третья и другие дальние координационные сферы. Этот процесс,
во-первых, определяет создание вокруг ионов толстых оболочек, во-вторых,
разрыхляет структуру оболочки, а в третьих, определяет непрерывное изменение к.ч.
Первичная координационная
сфера, образующаяся вокруг иона, имеет определенный (среднестатистический)
состав к строение, которое
можно установить на основе правил кристаллохимии (Л.Полккг).
Координационное число и толщина сольватной
оболочки зависит от заряда иона, размера молекул растворителя, размеров центрального
иона, концентрации раствора, температуры и природы растворителя. Сольватные
оболочки непрочны и обмениваются лигандами с молекулами растворителя. Прочность
сольватной оболочки определяется ее кинетической и термодинамической устойчивостью.
•Кинетическая устойчивость
определяется средним временем пребывания молекул растворителя в сольватной
оболочке
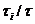 и разностью энергий
активации
и разностью энергий
активации 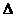 Е =
Е = 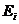 - Е, где
- Е, где 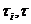 - время пребывания
молекул вблизи i-го
иона и в объеме растворителя; Е
- время пребывания
молекул вблизи i-го
иона и в объеме растворителя; Е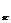 , Е - энергия активации процесса обмена молекул в растворе и в чистой жидкости
(обмен самодиффузией). Частоту смены молекул в сольватах и объеме жидкости можно рассчитать
по формуле
, Е - энергия активации процесса обмена молекул в растворе и в чистой жидкости
(обмен самодиффузией). Частоту смены молекул в сольватах и объеме жидкости можно рассчитать
по формуле
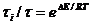

Можно
выделить следующие предельные величины в соотношениях: 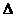 Е и
Е и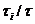 . Если
. Если
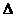 Е > 0, то
Е > 0, то
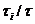 >1, и обмен
лигандов с
молекулами растворителя из его объема проходит реже по сравнению с процессом
обмена самодиффузией. Если
>1, и обмен
лигандов с
молекулами растворителя из его объема проходит реже по сравнению с процессом
обмена самодиффузией. Если 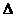 Е <0, то
Е <0, то 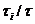 < I и процесс обмена лигандов сольватной
оболочки с молекулами растворителя облегчен.
< I и процесс обмена лигандов сольватной
оболочки с молекулами растворителя облегчен.
55. В
каких единицах выражаются концентрации. Методы пересчета одних концентраций в
другие.
Единицы
измерения состава растворов . свойства растворов
(физические и физико-химические) зависят от их состава. Наиболее простые соотношения между
составом и свойствами получены для идеальных растворов, свойства которых
меняются аддитивно, и только для таких растворов можно использовать простые единицы
для расчета их состава. Состав раствора определяют по количеству взятого в расчет самого раствора
или по количеству растворителя.
I. Расчет состава по количеству взятого в расчет
раствора
По этому способу для
расчета состава раствора применяют следующие единицы:
массовая
доля
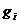 ,которая определяется как отношение
,которая определяется как отношение
массы
i -го
вещества
к общей массе раствора:
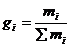 (3.1)
(3.1)
Умножением массовой
доли на 100 получают массовый процент.
мольная доля определяется
как отношение числа моль i -говещества в смеси к общему числу моль
веществ:
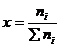 (3.2)
(3.2)
Умножив
мольную долю на 100, получают мольный процент.
М о л ь н о - объемная концентрация, или молярность
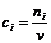 (3.3)
(3.3)
есть число моль
i -го вещества в единице объема раствора,
объемная доля (или градусы) определяется как отношение объема
данного вещества к общему объему раствора
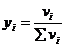 ;
;
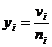
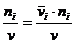
.где 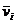 - парциальный мольный
объем. Эту единицу применяют для расчета состава жидких растворов, например
спирт-вода.
- парциальный мольный
объем. Эту единицу применяют для расчета состава жидких растворов, например
спирт-вода.
В химии для определения состава растворов часто
применяют нормальность,
молярность и титр. Нормальность определяется числом грамм-эквивалентов
вещества, растворенных в 1 кубическом
дм раствора, молярность - число моль вещества, содержащегося в Iкубическом дм раствора. Титром называют состав раствора,
выраженный числом граммов растворенного вещества в I кубическом см раствора.
2. Расчет состава раствора по количеству растворителя
М о л ь н о е отношение
определяется как отношение числа моль 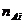 - вещества к числу моль
растворителя
- вещества к числу моль
растворителя 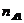
 .
. 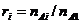 (3.4)
(3.4)
Моляльность определяется числом моль вещества, содержащегося в 1000 г чистого растворителя,
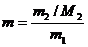 или, принимая,
или, принимая, 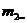 1000г, получим
1000г, получим
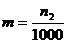
Для перехода от одних единиц
измерения состава раствора к другим составляются уравнения с учетом того, что
между единицами идеальных растворов
соблюдается пропорциональность.
56. Аналитическое выражение и физический смысл парциальны мольных величин. Методы их экспериментального и
расчетного определения.
Реальные смеси
веществ (газовые смеси, растворы) обладают экстенсивными и интенсивными свойствами. Для
идеальных растворов экстенсивные
свойства определяют аддитивное изменение состава при увеличении его массы. Для
реальных растворов объем, энтропия, внутренняя
энергия, А и G меняются неаддитивно с изменением состава раствора в
расчете на число моль данного компонента в смеси. Эти свойства
приобретают уже свойства интенсивных параметров. Это связано с тем, что
между частицами в растворе проявляются ММВ разные по силе и природе,
которые определяют отклонение свойств реальных растворов от идеальных.
Изменение соответствующего вещества
раствора с изменением числа молей i-го компонента в нем при p, T=const – парциальная мольная величина.
Аналитически парциальные мольные величины
записывают в виде:
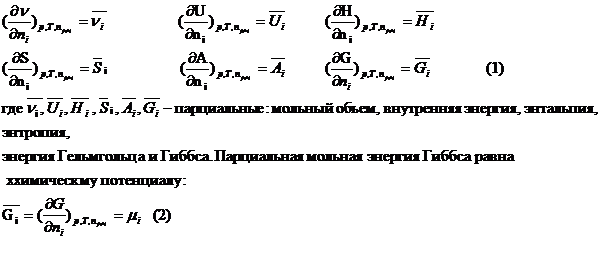 Термодинамические уравнения при использовании
парциальных мольных величин имеют такой же вид, что и уравнения для индивид. веществ.
Термодинамические уравнения при использовании
парциальных мольных величин имеют такой же вид, что и уравнения для индивид. веществ.
Пусть функция вида
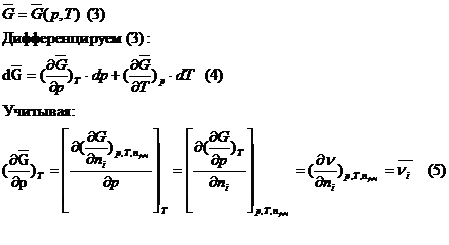
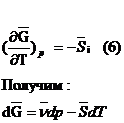
Методы
экспериментального и расчетного определения парциальных мольных величин.
Можно определить
аналитическим и графическим методом.
Аналитический метод :
определяют экстенсивное свойство р-ра при различном числе молей (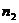 ) в одном и том же кол –ве
растворителя при р,Т=const.
) в одном и том же кол –ве
растворителя при р,Т=const.
Графические методы:
1.
Метод отрезков.
Для 1 моля раствора: 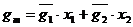
Строят зависимость
экстенсивного свойства от состава
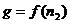
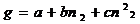
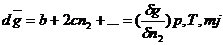
2.
По тангенсу угла
наклона касательной.
Определяют
g для различных 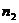 ; строят зависимость g=f(
; строят зависимость g=f(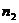 ). Проводят касательную к точке
). Проводят касательную к точке 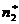 ;
; 
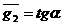 ,при
,при 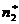 моль
в-ренного вещества.
моль
в-ренного вещества.
3. Определение 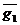 по известным
по известным 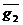 (один и второй
компоненты)
(один и второй
компоненты)
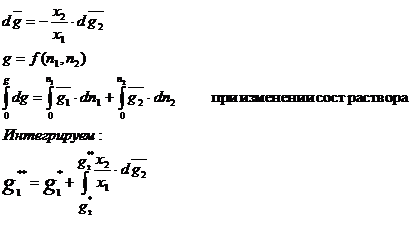
Строят график 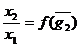
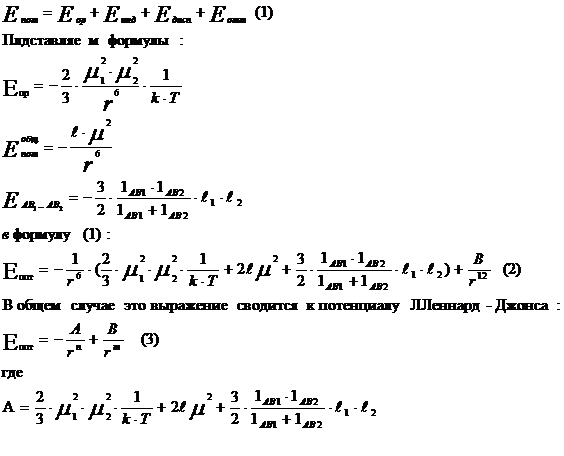
![]() (4)
(4)
![]() - отталкиванию молекул. Суммарная кривая изменения потенциальной энергии при сближении молекул определяется кривой авс. При сближении молекул, начиная от расстояния
- отталкиванию молекул. Суммарная кривая изменения потенциальной энергии при сближении молекул определяется кривой авс. При сближении молекул, начиная от расстояния ![]() , может производиться работа в этой системе силами притяжения, которая идет на увеличение кинетической энергии. В точке "в" молекулы будут находиться на равновесном расстоянии друг от друга, когда силы отталкивания будут уравновешивать силы притяжения. Система из двух молекул на таком расстоянии будет обладать минимумом потенциальной энергии, то есть мин. избытком потенциальной энергии.
, может производиться работа в этой системе силами притяжения, которая идет на увеличение кинетической энергии. В точке "в" молекулы будут находиться на равновесном расстоянии друг от друга, когда силы отталкивания будут уравновешивать силы притяжения. Система из двух молекул на таком расстоянии будет обладать минимумом потенциальной энергии, то есть мин. избытком потенциальной энергии.![]() ,
,![]() и равновесное расстояние
и равновесное расстояние ![]() Минимум на потенциальной кривой характеризуется равенствами:
Минимум на потенциальной кривой характеризуется равенствами: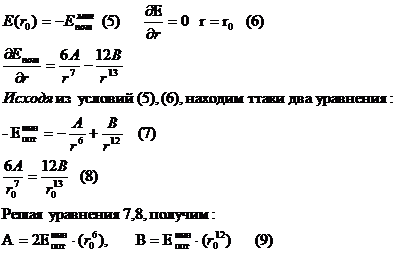
 Кривые потенциальной энергии используют при обьяснении
адсорбции и десорбции молекул
углеводородов.
Кривые потенциальной энергии используют при обьяснении
адсорбции и десорбции молекул
углеводородов.
![]()
![]() -
статическая электрическая
проницаемость;
-
статическая электрическая
проницаемость;![]() - диэлектрическая
проницаемость, обусловленная электронной и атомной поляризуемостью полярных
молекул;
- диэлектрическая
проницаемость, обусловленная электронной и атомной поляризуемостью полярных
молекул;![]() - число
Авогадро;
- число
Авогадро;![]() - объем, занимаемый I
молем полярного вещества в изотропной падкости;
- объем, занимаемый I
молем полярного вещества в изотропной падкости;![]() - дипольный момент;
- дипольный момент;![]() - энергия I
моля полярного вещества в растворе.
- энергия I
моля полярного вещества в растворе.![]() в зависимости от состава раствора.
в зависимости от состава раствора.