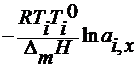65. Осмос. Определение осмотического давления и
уравнения его вычисления.
Осмос – это самопроизвольный переход растворителя в раствор через
полупроницаемую перегородку. Избыточное давление, которое необходимо приложить
к раствору на высоте h = 0, чтобы воспрепятствовать
проникновению растворителя в раствор, называют осмотическим давлением. Величина этого давления равна весу столба
жидкости в трубке высотою h.
Осмотическое
давление может быть рассчитано по выражению
![]()
где
ρ- плотность
раствора,
g – сила
земного притяжения,
h – вес
столба жидкости.
Величина
осмотического давления зависит от концентрации раствора. Вант-Гофф
установил, что осмотическое давление растворов прямолинейно меняется с
изменением их концентрации, а произведение их осмотического давления на объём
раствора, содержащего 1 моль растворенного вещества, есть величина постоянная и
равна
π∙ν = 22,9
Дж/моль
Осмотическое
давление равно такому давлению, которое развивало бы растворенное вещество в
заданном объёме раствора, если бы оно находилось в идеальном газообразном
состоянии и занимало бы объём указанного раствора.
Растворы,
обладающие одинаковыми осмотическими давлениями, называют изоосмотическими. Для
растворов одинакового объёма осмотическое давление прямо пропорционально
температуре:
π/T = const
для
разбавленных растворов неэлектролитов: π∙ν/T = R
учитывая,
что ν = 1/C, получаем уравнение Вант-Гоффа:
π = cRT
66. Термодинамический вывод уравнения Вант-Гоффа осмотического давления.
![]()
Пусть
в заданном сосуде давление, развиваемое 1 молем пара от Ро
до Р, производит работу за счёт изменения величины потенциальной энергии,
которую можно определить по выражению 1-го закона термодинамики при Т=const в таком виде:
dW = - vdp
знак
минус определяет затраченную системой работу. Для идеального газа v = RT/p, откуда получим
dW = -RT dp/p
интегрируем
в пределах от Ро до Р:
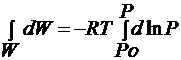 W = RT ln
W = RT ln
1
моль вещества можно механически перенести на высоту h, затрачивая работу
W = Mgh, где М – молекулярная масса растворителя.
Тогда Mgh = RT ln Po /P
Откуда
h = ![]()
![]()
Для
разбавленного раствора давление насыщенного пара над чистой жидкостью po = p + ∆p
![]()
Для разбавленных растворов ∆p/р<<1, тогда
![]()
![]()
допуская
ρ = n1/v и М=М1, получим
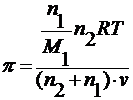 при n2<<n1
находим
при n2<<n1
находим
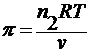
67. Связь осмотического давления с понижением давления
для разбавленных растворов.
Осмометр
термостатирован. В нём через некоторое время
устанавливается динамическое равновесие, которое характеризуется равенством
скоростей обмена жидкостью между раствором и растворителем через пленку.
В
равновесном состоянии системы давление пара над поверхностью чистой жидкости
будет равно Ро, а над поверхностью
раствора на высоте h – P = P’. Давление
пара Ро над уровнем чистой жидкости будет
выше, чем давление над раствором на высоте h на величину ∆Р = Ро
– Р. Условие равенства Р = Р’ над раствором на высоте h доказывается невозможностью построения вечного
двигателя при Т = const, в равновесной изолированной
системе. Этот двигатель невозможно построить и в открытых системах.
![]()
где
ρ- плотность
раствора, кг/м3;
g – сила
земного притяжения, м/c2;
h –
высота, м.
В
этом случае π имеет размерность н/м2 . Изменение давления насыщенного пара
растворителя с изменением высоты h можно
определить по формуле Лапласа
h = ![]() откуда
откуда
![]()
Для
разбавленного раствора давление насыщенного пара над чистой жидкостью po = p + ∆p
![]()
Для разбавленных растворов ∆p/р<<1, тогда
![]()
 68.
Термодинамический вывод уравнения, связывающего понижение температуры
замерзания с моляльностью.
68.
Термодинамический вывод уравнения, связывающего понижение температуры
замерзания с моляльностью.
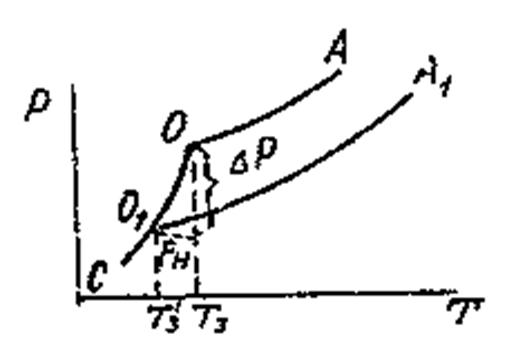
Жидкость
замерзает при условии, что давление насыщенного пара над нею равно давлению над
твёрдым телом. На рис. Это условие выполняется в точке пересечения кривых СО и
ОА, при температуре Т3. Раствор также замерзает, когда давление пара
над ним будет равно давлению насыщенного пара над твёрдым растворителем, что
определяется точкой О1 от пересечения кривых О1А1
и СО1. В этой точке давление ниже, чем в точке О, поэтому раствор
замерзает при более низкой температуре, чем чистая жидкость, то есть при Т3’.
Давление над разбавленным раствором снижается согласно закону Рауля
рн = р1о х1
,
где
рн , р1о
– давление над твёрдым телом в растворе и чистым растворителем.
lnрн = lnр1о + lnх1
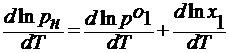
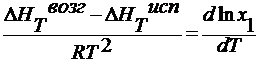
∆HTвозг, ∆HTисп
– мольные теплоты возгонки и испарения Дж/моль.
∆ HTпл = ∆ HTвозг - ∆ HTисп
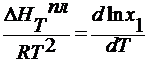
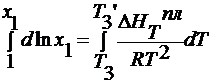
для разбавленных растворов Т3
- Т3’ мала, поэтому ∆ HTпл = const:
lnx1 =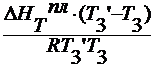 для бинарной смеси х1 = 1- х2
для бинарной смеси х1 = 1- х2
-ln(1-x2 )=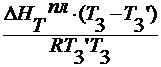
для разбавленных растворов Т3
≈ Т3’ , x2<<1.
-ln(1-x2 ) = x2
x2 = 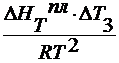
для разбавленных растворов n1>>n2, тогда x2 =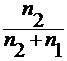 :
:
x2 =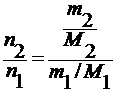
∆T3=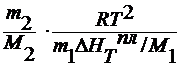
∆ HTпл /M1=ρпл –
удельная теплота плавления
∆T3=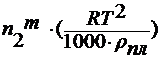
∆T3=![]() ,
,
где n2m –
моляльность раствора;
E3 – эбулиоскопическая
константа.
69. Термодинамический вывод уравнения,
связывающего повышение температуры кипения раствора с его моляльностью.
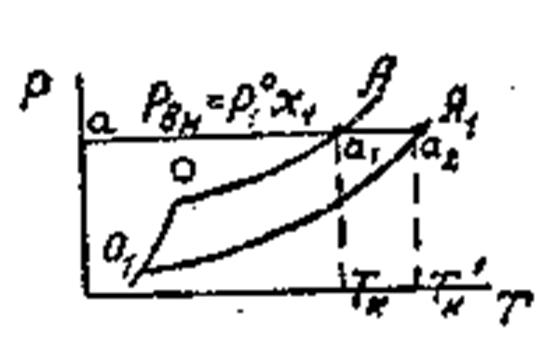
На
рис. кривые ОА и О1А1 определяют изменение давления
насыщенного пара над чистой жидкостью и над раствором. Для определения условий,
при которых закипают жидкости, проводим изобару внешнего давления, которая
пересекает кривые в точках а1 и а2. Эти точки определяют Ткип чистой жидкости и раствора. Жидкость
закипает при условии, что давление пара её равно внешнему давлению. Над
раствором давление пара ниже, чем над чистой жидкостью, на величину∆р,
поэтому для закипания раствора его необходимо дополнительно нагреть до Тк’,
причем
Тк’ >Тк
Формула закона Рауля для
растворителя
р1 = р1о х1
рвн = р1о х1= const
lnрвн = lnр1о + lnх1
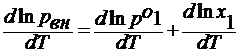
![]()
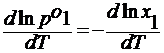
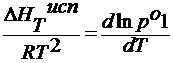
∆HTисп – молекулярная теплота испарения жидкости, Дж/моль.
для бинарной смеси х1
= 1- х2
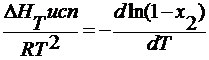
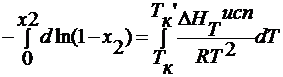
-ln(1-x2 )=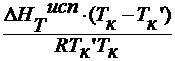
для разбавленных
растворов x2<<1.
-ln(1-x2 ) = x2
x2 = 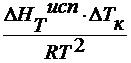
n1>>n2, тогда
x2 =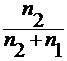 :
:
x2 =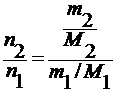
∆Tк=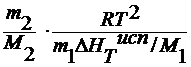
∆ HTисп /M1=L –
удельная теплота испарения
∆Tк=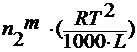
∆Tк=![]() ,
,
где n2m –
моляльность раствора;
Eк – эбулиоскопическая константа.
70. Свойства разбавленных растворов
электролитов и методы их вычисления. Изотонический коэффициент.
Разбавленные
растворы электролитов – солей, оснований, кислот в воде – показывают
систематические отклонения от свойств идеальных растворов. Эти отклонения связаны
с тем, что молекулы электролита в водном растворе распадаются на ионы, и в
единице объёма раствора будет содержаться большее число частиц, чем в исходной
загрузке соли, кислоты, основания.
Для расчета
свойств разбавленных растворов электролитов необходимо уравнения законов
идеальных растворов исправить, введя в них коэффициент, учитывающий изменение
числа частиц в растворе вследствие диссоциации или ассоциации растворенного
вещества. Этот коэффициент обозначают i и называют изотоническим
коэффициентом. Он показывает отношение числа частиц, образующихся в
растворе, к числу частиц в исходной порции вещества. Для электролитов:
АВ = А+ + В-
N(1-α) Nα Nα
α=N1/N
N1 – число
образовавшихся ионов или распавшихся молекул
N(1-α) – число нераспавшихся молекул
Σ Ni = N - Nα +Nα +Nα
i= Σ
Ni/N = 1+α
если исходные молекулы распадаются на ν новых частиц, то
Σ Ni = N[1+α(ν-1)] i= Σ Ni/N = 1+α(ν-1)
если α=0, то i=1, если α=1, то i=ν.
1<= i <= ν
Для раствора, в котором молекулы растворенных веществ
ассоциируют друг с другом:
nA = An
N(1-α) Nα/n
Nα/n – число
ассоциированных молекул
N(1-α) – число
исходных молекул
Σ Ni = N
- Nα +Nα/n i=
Σ Ni/N =
1+α(1/n -1)
1/n <= i <= 1
С учетом этой поправки законы разбавленных растворов
электролитов запишутся:
π = i cRT
∆p/po = i n2/(n1
+ i n2),
∆p/po = i
n2/n1
i = πоп/πрасч = (∆p/p)оп/(∆p/p)расч = ∆T3 оп /∆T3 расч = ∆Tк оп /∆Tк расч
71. Определение молекулярной массы
растворенного вещества по понижению температуры замерзания раствора, по
повышению температуры кипения раствора и по осмотическому давлению.
1 . по
понижению температуры замерзания раствора
x2 = 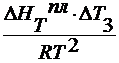
для разбавленных растворов n1>>n2, тогда x2 =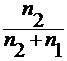 :
:
x2 =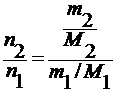 ∆T3=
∆T3=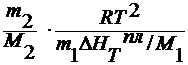
∆ HTпл /M1=ρпл –
удельная теплота плавления
M2 = 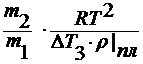 M2 =
M2 =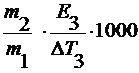 ,
,
где ∆T3 – понижение
температуры замерзания раствора;
E3 – эбулиоскопическая константа.
2. по повышению температуры кипения
раствора
x2 = 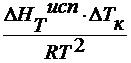 , n1>>n2, тогда x2 =
, n1>>n2, тогда x2 =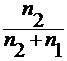 :
:
x2 =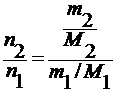 ∆Tк=
∆Tк=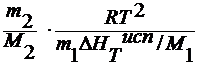
∆ HTисп /M1=L –
удельная теплота испарения
M2 = 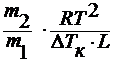 M2 =
M2 =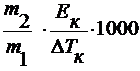 ,
,
где ∆Тк
– повышению температуры кипения раствора;
Eк – эбулиоскопическая константа.
3.
по осмотическому давлению
уравнение
Вант-Гоффа:
π = cRT
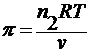 → πν
=
→ πν
= 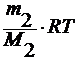 → M2 =
→ M2 = ![]() ,
,
где π – осмотическое давление.
72. Методы расчета активностей и
коэффициентов активности растворителя и растворенного вещества по давлению
насыщенного пара, осмотическому давлению, по повышению температуры кипения и
понижению температуры замерзания растворов.
ai,x = γi,x
xi ,
где ai,x – активность,
γi,x - коэффициент активности.
1. по давлению
насыщенного пара
pi = pi0 ai,x закон Рауля
2. по
осмотическому давлению
![]()
3. по повышению
температуры кипения
∆Tк=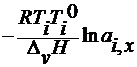
4. по понижению температуры замерзания растворов
∆T3=