9. Закон Гесса. Как вычислить
стандартную теплоту образования вещества?Вычисление
тепловых эффектов по энтальпиям образования вещества и по теплотам
сгорания вещества
Теплота реакции в общем не является изменением функции
состояния и зависит от пути процесса. Однако по крайней мере в двух простейших
случаях независимость от пути распространяется и на теплоты процесса.
Если реакция протекает при постоянных объёме и
температуре (T = const и V = const) и при этом не совершается работа ![]() , то согласно уравнению (I,57):
, то согласно уравнению (I,57):
![]() (I, 60) , где
(I, 60) , где ![]() =
= ![]()
Тогда, разделив обе части уравнения (I, 60) на ![]() , получим:
, получим: ![]()
![]() Принимая во внимание, что T = const
и V = const,
частную производную
Принимая во внимание, что T = const
и V = const,
частную производную ![]() можно заменить на полную производную
можно заменить на полную производную ![]() , из чего следует, что
, из чего следует, что
После
интегрирования получим: ![]() (I, 61)
(I, 61)
Если D![]() , то
, то ![]()
Аналогично, если реакция протекает при постоянных
давлении и температуре
(T = const и Р = const), то согласно уравнению (I,59)
![]() где
где ![]()
тогда ![]() и
и ![]() (I, 62)
(I, 62)
Если D![]() , то
, то ![]()
Таким образом, в указанных двух случаях теплота
процесса (тепловой эффект реакции) равна изменению функций состояния и по этой
причине обладает свойствами этих функций состояния - не зависит от пути
процесса, а лишь от начального и конечного состояний. Указанный закон был
открыт в
1. Тепловой эффект
прямой реакции равен по величине и противоположен по знаку тепловому эффекту
обратной реакции (так называемый закон Лавуазье – Лапласа).
2. Для двух
реакций, имеющих одинаковые исходные, но разные конечные состояния, разность
тепловых эффектов представляет собой тепловой эффект перехода из одного
конечного состояния в другое.
3. Для двух
реакций, имеющих одинаковые конечные, но разные исходные состояния, разность
тепловых эффектов представляет собой тепловой эффект перехода из одного исходного
состояния в другое.
4. Тепловой эффект
химической реакции равен разности сумм теплот образования продуктов реакции и
исходных веществ, умноженных на стехиометрические коэффициенты.
![]() (I,
65)
(I,
65)
Теплотой образования соединения называется тепловой
эффект реакции образования одного моля
соединения из соответствующих простых веществ, находящихся в той модификации и
том агрегатном состоянии, которые устойчивы при данной температуре и давлении 1
атм.
5. Тепловой эффект
химической реакции равен разности сумм теплот сгорания исходных веществ и
продуктов реакции, умноженных на стехиометрические коэффициенты.
![]() (I, 66)
(I, 66)
Теплотой сгорания соединения
называется тепловой эффект реакции взаимодействия 1 моль химического соединения
и кислорода с образованием высших стабильных оксидов (Н2О (жидк.), СО2 и т.д.) или других строго
выбранных соединений (N2, SO2, HCl, HBr, HI и т.д.).
Величины тепловых эффектов химических реакций
зависят от условий, в которых проводятся реакции. Поэтому табличные значения
теплот различных процессов принято относить к стандартному состоянию. Стандартное
состояние характеризуется стандартными условиями: давлением Р0, температурой Т0, составом (мольная доля x0). Комиссия (IUPAC) определила в качестве основного стандартного состояния для всех
газообразных веществ чистое вещество (х0
= 1) в состоянии идеального газа с давлением Р0 = 1 атм.
(1,01325 · 105 Па) при
любой фиксированной температуре. Для твердых и жидких веществ основное
стандартное состояние - это состояние чистого вещества (х0 = 1), находящегося под внешним давлением Р0 = 1 атм., или, что совпадает по смыслу, при давлении насыщенных паров
над этим веществом, равном 1 атм. В
определение стандартного состояния IUPAC Т0 не входит, хотя часто говорят о стандартной температуре, равной 298,15 К.
10. Покажите, как связаны тепловые эффекты реакций,
проводимых при постоянном давлении и постоянном объеме.
При условии протекания в системе химических или фазовых превращений
энтальпию также следует рассматривать как функцию ![]() . Тогда:
. Тогда:
![]() (I,58)
(I,58)
Принимая во внимание определение энтальпии (I, 51) и (I, 31), после
дифференцирования можем записать:
![]() (I, 58а)
(I, 58а)
![]() (I, 58б)
(I, 58б)
Если Р = const и l = const, то ![]() . Итак, окончательно получим:
. Итак, окончательно получим:
![]() (I,59)
(I,59)
где
![]() =
= ![]() - это тепловой эффект химической реакции, протекающей до
конца (D
- это тепловой эффект химической реакции, протекающей до
конца (D![]() ), при
), при ![]() и
и ![]() . Он равен изменению энтальпии системы. Принимая во внимание определение энтальпии
(I, 51), также можно записать:
. Он равен изменению энтальпии системы. Принимая во внимание определение энтальпии
(I, 51), также можно записать: ![]()
Первые два слагаемых в правой части уравнения по первому закону
термодинамики (смотри (I, 7а)) равны ![]() , тогда :
, тогда :![]() (I, 59а)
(I, 59а)
Следовательно, ![]() и с учётом (I,59) для элементарной теплоты получаем:
и с учётом (I,59) для элементарной теплоты получаем:![]()
Тепловой эффект
химической реакции – это количество теплоты, выделившейся или поглощённой при
протекании реакции до конца (D![]() ) и постоянных значениях параметров системы.
) и постоянных значениях параметров системы.
Это понятие
следует отличать от понятия теплоты реакции, которое не имеет такого строгого
термодинамического смысла как тепловой эффект. Теплота реакции – опытная
величина, она может быть определена во всех случаях, когда реакция протекает не
до конца или, например, температура исходных веществ и продуктов реакции отличаются
и т.д. По этой причине теплота реакции не несёт какой-либо существенной
информации об особенностях протекающих в системе химических превращений и имеет
ограниченное применение.
Также см. 9
вопрос.
11. Выведите уравнение зависимости теплового эффекта реакции
от температуры
Запишем уравнение
химической реакции в общем виде:
![]()
Через Hi обозначим энтальпию i-ого реагента, отнесённую к 1 моль вещества. Так как в
результате одного пробега реакции исчезает ![]() моль исходных веществ и появляется
моль исходных веществ и появляется ![]() моль продуктов
реакции, то общее изменение энтальпии в процессе будет:
моль продуктов
реакции, то общее изменение энтальпии в процессе будет:
![]()
Продифференцируем это
уравнение по температуре при P=const: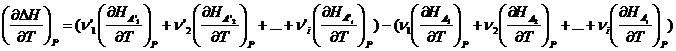 Если теперь ввести обозначения:
Если теперь ввести обозначения:
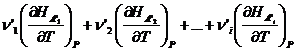 =
= 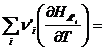
![]()
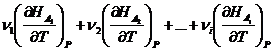 =
= 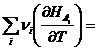
![]()
и
принять во внимание, что ![]() есть истинная теплоёмкость
есть истинная теплоёмкость ![]() , то тогда
, то тогда
![]()
где ![]() и
и ![]() . Или окончательно
. Или окончательно ![]()
Как для идеальной системы, так и для реальных систем
при невысоких давлениях частную производную от теплового эффекта по температуре
можно заменить полной производной:
![]() (I, 67)
(I, 67)
Это уравнение впервые было выведено Кирхгофом и называется его именем.
Интегрирование уравнения (I, 67) дает следующее выражение:
![]()
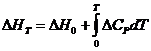 (I, 67а)
(I, 67а)
Где ![]() - тепловой эффект реакции при заданной температуре, а
- тепловой эффект реакции при заданной температуре, а ![]() - константа
интегрирования.
- константа
интегрирования.
12. Понятие о обратимых и необратимых процессах расширения
газа. Могут ли необратимые процессы стать обратимыми?
Обратимым процессом называется равновесный процесс, который в
прямом и обратном направлениях протекает через одни и те же промежуточные
состояния, а сама система возвращается в исходное состояние.
Наиболее часто встречающимися
и безусловно самопроизвольными являются процессы передачи теплоты от горячего
тела к холодному (теплопроводность) и перехода работы в теплоту (трение). Многовековая
житейская, техническая и научная практика человечества показали невозможность
самопроизвольного протекания обратных процессов, очень заманчивых с
практической точки зрения (получение работы за счет отнятия теплоты у тел,
окружающих рабочее тело). Это дает основание утверждать, что единственным
результатом любой совокупности процессов не может быть переход теплоты от менее
нагретого тела к более нагретому (постулат
Клаузиуса).
Обратный указанному переход
теплоты от более нагретого тела к менее нагретому – это обычный
неравновесный процесс передачи теплоты путем теплопроводности. Он не может быть
обращен, т. е. проведен в обратном направлении через ту же
последовательность состояний. Но этого мало: если в системе прошел процесс
прямой передачи теплоты, то никаким образом нельзя осуществить такую
последовательность любых процессов, в результате которой все тела,
участвовавшие в передаче теплоты, пришли бы в исходное состояние и не произошло
бы никаких изменений в других телах. Процесс теплопроводности необратим.
Существует функция состояния термодинамической системы –
энтропия. При обратимых процессах в изолированной системе её энтропия не
изменяется, а при необратимых (самопроизвольных) – увеличивается.
Указанный количественный критерий направления
процесса также может быть найден путём исследования цикла Карно с
использованием основных формулировок второго закона термодинамики.
13. Теорема о самопроизвольных и несамопроизвольных
процессах и её доказательство
Существует функция состояния
термодинамической системы – энтропия.
При обратимых процессах в изолированной системе её энтропия не изменяется, а
при необратимых (самопроизвольных) – увеличивается.
Единственным результатом
любой совокупности процессов не может быть превращение теплоты в работу
(т. е. поглощение системой теплоты из окружающей среды и отдача
эквивалентной этой теплоте работы). Таким образом, самопроизвольный процесс
превращения работы в теплоту (путем трения) необратим (так же, как и
теплопроводность).
Установим, какое количество теплоты δQ нужно
затратить, чтобы перевести газ из состояния (P,V,T) в бесконечно близкое состояние (P+dP, V+dV, T+dT). δQ = PdV + СvdT
Исключим из
этого уравнения dT. Для этого продифференцируем уравнение Менделеева-Клапейрона: PdV + VdP = RdT и определим из
него dT:
![]() . После подстановки получим:
. После подстановки получим: ![]()
Принимая во внимание, что СV + R = CP , окончательно получим:
![]() и
и ![]()
Полученное уравнение позволяет утверждать, что теплота
Q не
является функцией состояния и зависит от пути процесса, который к этому
состоянию привел, т.к. условие интегрируемости здесь явно нарушено:
![]() , т.к.
, т.к. ![]() .
.
Однако если выражение для элементарной теплоты
умножить на ![]() , где
, где ![]() есть абсолютная
температура, то придем к выражению:
есть абсолютная
температура, то придем к выражению:
![]() ,которое явно представляет собой полный дифференциал.
Первообразной здесь служит функция, которую мы обозначим S:
,которое явно представляет собой полный дифференциал.
Первообразной здесь служит функция, которую мы обозначим S:
![]() ;
; ![]()
Криволинейный интеграл ![]() не зависит от пути
интегрирования и отличается от указанной выше функции S лишь
постоянной.
не зависит от пути
интегрирования и отличается от указанной выше функции S лишь
постоянной.
Полученный нами результат даёт косвенное
доказательство существования некой новой функции состояния, названной энтропией, а также её количественной
меры.
14. Формулировки 11 закона термодинамики. Докажите, что КПД
машины не зависит от природы рабочего вещества.
Единственным результатом
любой совокупности процессов не может быть переход теплоты от менее нагретого
тела к более нагретому (постулат Клаузиуса).
Единственным результатом
любой совокупности процессов не может быть превращение теплоты в работу
(т. е. поглощение системой теплоты из окружающей среды и отдача
эквивалентной этой теплоте работы). Таким образом, самопроизвольный процесс
превращения работы в теплоту (путем трения) необратим (так же, как и
теплопроводность).
Последнее утверждение может
быть изложено иначе: теплота наиболее холодного из участвующих в процессе тел
не может служить источником работы (постулат
Томсона).
Предположим, что вторая из
приведенных выше формулировок (особенно в последней ее форме) неправильна.
Тогда можно было бы
построить машину, работающую циклами, «рабочее тело» которой периодически
возвращалось бы в исходное состояние, причем эта машина давала бы работу за
счёт теплоты, поглощаемой извне от тела, не более нагретого, чем сама система и
все другие окружающие систему тела. Такой процесс протекал бы без нарушения
первого закона термодинамики (работа за счет теплоты), но для практики он
равноценен получению работы из ничего, так как всякая машина имела бы
практически неисчерпаемый источник теплоты в окружающей среде. Так пароход мог
бы двигаться, отнимая теплоту океанской воды и не нуждаясь в топливе. Такая
машина называется перпетуум-мобиле
(вечный двигатель) второго рода. Исходя из этого определения, можно
сформулировать второй закон термодинамики, придав постулату Томсона иную форму:
перпетуум-мобиле второго рода невозможен.
Существует функция состояния
термодинамической системы – энтропия. При обратимых процессах в
изолированной системе её энтропия не изменяется, а при необратимых
(самопроизвольных) – увеличивается.
Теорема Карно-Клаузиуса: коэффициент полезного
действия тепловой машины, работающей обратимо по циклу Карно, не зависит от
природы рабочего тела машины, а лишь от температуры нагревателя и температуры
холодильника.
Рассмотрим две машины – 1 и 2 (рис.2),
рабочими телами в которых являются два разных вещества. Обе машины работают в
одном и том же интервале температур от Т1 (нагреватель) до Т2
(холодильник).
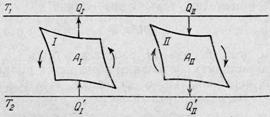
Рис.2. Схема для доказательства теоремы Карно-Клаузиуса.
Машина 1 работает равновесно и обратимо.
Заставив машину 1 работать в обратном направлении, а машину 2 в прямом
направлении, подберём размеры машин так, чтобы производимые ими работы были
равны по абсолютной величине (т.е. так, чтобы площади циклов на диаграмме P
– V были равны): ![]() . Пусть при этом теплота, получаемая рабочим телом машины 2 у
нагревателя, и теплота, отдаваемая им холодильнику, равны Q2 и Q’2, а теплота, отдаваемая
рабочим телом машины 1 нагревателю, и теплота, получаемая им от холодильника,
равны Q1 и Q’1 соответственно.
. Пусть при этом теплота, получаемая рабочим телом машины 2 у
нагревателя, и теплота, отдаваемая им холодильнику, равны Q2 и Q’2, а теплота, отдаваемая
рабочим телом машины 1 нагревателю, и теплота, получаемая им от холодильника,
равны Q1 и Q’1 соответственно.
Так как ![]() , а
, а ![]() , то
, то
![]() =
= ![]() (II,1)
(II,1)
Предположим, что коэффициент полезного
действия (кпд) ![]() машины 2 больше, чем кпд
машины 2 больше, чем кпд ![]() машины 1, т.е.
машины 1, т.е.
![]() >
>![]()
Принимая во внимание уравнение (II,1), получаем:
Q1 > Q2 Q’1 > Q’2
Пусть обе машины работают совместно так,
что работа ![]() , полученная в машине 2, затрачивается в машине 1. При этом
нагреватель отдаёт машине 2 теплоту Q2, и
получает от машины 1 теплоту Q1. Так как Q1 > Q2, то
в итоге нагреватель получает теплоту
, полученная в машине 2, затрачивается в машине 1. При этом
нагреватель отдаёт машине 2 теплоту Q2, и
получает от машины 1 теплоту Q1. Так как Q1 > Q2, то
в итоге нагреватель получает теплоту
(Q1 -
Q2).
Холодильник отдает теплоту (Q’1
– Q’2), равную (Q1 -
Q2).
Суммарная же работа обеих машин равна нулю ![]() . Таким образом, единственным результатом совместного
действия двух машин является перенос теплоты от холодильника к нагревателю. По
второму закону термодинамики (формулировка Клаузиуса)
это невозможно и, следовательно, предположение, что
. Таким образом, единственным результатом совместного
действия двух машин является перенос теплоты от холодильника к нагревателю. По
второму закону термодинамики (формулировка Клаузиуса)
это невозможно и, следовательно, предположение, что ![]() >
>![]() неправильно.
неправильно.
Очевидно,
независимо от того, работает манина 2 обратимо или
необратимо, возможны только два случая:
![]() (II,2)
(II,2)
Допустим,
что машина 2 работает обратимо. В этом случае можно заставить обе машины
обменяться ролями (машина 1 обратима по первоначальному условию). Повторив
изложенное рассуждение, можно прийти к выводу, что:
![]()
Очевидно,
что этот вывод совместим с предыдущим лишь при условии, что единственное
решение – это равенство, т.е. кпд двух машин:
![]() , (II,3)
, (II,3)
что и требовалось доказать.
15. Выведите выражение для энтропии на основании сравнения
работы любого цикла с работами бесконечно большого числа элементарных циклов
Карно.
Любой цикл можно заменить бесконечно
большим числом бесконечно малых циклов Карно, ограниченных бесконечно малыми отрезками
изотерм и конечными отрезками адиабат. Теорема
Карно: коэффициент полезного действия цикла Карно больше
коэффициента полезного действия любого цикла между теми же температурами.
Разобьём
произвольный цикл abcd (рис.3) бесконечно большим количеством адиабат, а
через отрезки цикла, заключенные между адиабатами, проведём изотермы. При этом
получится бесконечно большое количество бесконечно малых циклов Карно. Можно
считать, что площадь всего цикла abcd совпадает
с суммой площадей всех бесконечно малых циклов Карно.
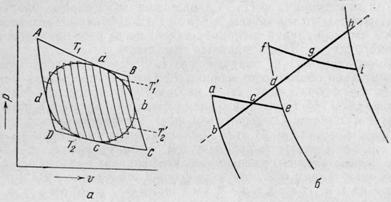 Рис.3.
Произвольный цикл из бесконечно малых циклов Карно.
Рис.3.
Произвольный цикл из бесконечно малых циклов Карно.
Из
сказанного выше следует, что любой цикл можно заменить совокупностью бесконечно
малых циклов Карно. Это, в свою очередь, означает, что теплота и работа
произвольного цикла равны соответственно сумме теплот и сумме работ
совокупности бесконечно малых циклов Карно. Легко показать, что средний кпд
произвольного цикла меньше кпд цикла Карно, протекающего между двумя крайними
температурами Т1 и Т2 (цикл ABCD
на рис.3). Действительно, каждый элементарный цикл Карно протекает между
температурами Т’1 и Т’2 , причём ![]() и
и ![]() (
(![]() и
и ![]() больше нуля). Поэтому
кпд элементарного цикла Карно
больше нуля). Поэтому
кпд элементарного цикла Карно
![]() <
< ![]() (II,4)
(II,4)
Средний
коэффициент ![]() любого цикла,
очевидно, также меньше h цикла Карно между крайними температурами, что и
требовалось доказать. Так как кпд обратимого цикла Карно не зависит от природы
рабочего вещества, то уравнение (II,4) относится
к любым обратимым циклам Карно (знак равенства) и любым произвольным циклам с
максимальной температурой Т1 и минимальной температурой Т2
(знак неравенства). Следовательно, выражение для кпд циклического процесса, записанное
в виде
любого цикла,
очевидно, также меньше h цикла Карно между крайними температурами, что и
требовалось доказать. Так как кпд обратимого цикла Карно не зависит от природы
рабочего вещества, то уравнение (II,4) относится
к любым обратимым циклам Карно (знак равенства) и любым произвольным циклам с
максимальной температурой Т1 и минимальной температурой Т2
(знак неравенства). Следовательно, выражение для кпд циклического процесса, записанное
в виде ![]() (где Т1
и Т2 – максимальная и минимальная температуры теплообмена
рабочего тела с источниками теплоты) является общим законом.
(где Т1
и Т2 – максимальная и минимальная температуры теплообмена
рабочего тела с источниками теплоты) является общим законом.
16. Покажите, как рассчитать изменение энтропии газов в
идеальном состоянии при изменении параметров системы.
Уравнения, определяющие энтропию, являются единственными исходными
уравнениями для термодинамического расчета изменения энтропии системы. dS = ![]() =
= ![]() +
+ ![]() (II, 18);dS =
(II, 18);dS = ![]() +
+ ![]() (II, 19)
(II, 19)
Уравнения (II, 18) и (II, 19) являются полными дифференциалами
энтропии как функции переменных V,
Т или P, Т.
Коэффициенты этих уравнений – частные производные энтропии по
соответствующим переменным.
Подставив в уравнение (II, 18) значения калорических коэффициентов
для одного моля идеального газа: l =
P =
RT/V (уравнение (I, 37)) и h = –V = –RT/P (уравнение (I, 39)) и полагая СV и СP независимыми от температуры (что допустимо
лишь в небольших температурных интервалах), получим после интегрирования в
известных пределах:
DS = ![]() +
+ 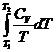 =
= ![]() +
+ 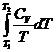 =
=![]() R ln
R ln![]() +
+ ![]()
![]() (II,20)
(II,20)
DS = – ![]() +
+ 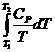 = -
= -![]() +
+ 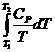 = -R ln
= -R ln![]() + CP ln
+ CP ln![]() (II,21)
(II,21)
Применим полученные выше
соотношения для расчетов изменения энтропии при некоторых процессах:
1. Фазовые превращения
(изотермические процессы; Т = const):
S2 – S1 = DS = ![]() =
= ![]() =
= ![]() (II, 22)
(II, 22)
2.
Нагревание при постоянном давлении (изобарный процесс; P = const). Из уравнений (I, 16) и (II, 13) получаем:
DS = 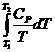 (II, 23)
(II, 23)
3. Смешение двух идеальных газов
(изобарно-изотермический процесс). В смеси идеальных газов компоненты ведут
себя независимо друг от друга, поэтому энтропия смеси идеальных газов является
аддитивной функцией состава. При смешении двух газов в количестве ![]() и
и ![]() при постоянных
температуре и давлении после удаления разделяющей их перегородки каждый газ
изменяет свой объем от первоначального до объема смеси, равного сумме исходных
объемов (
при постоянных
температуре и давлении после удаления разделяющей их перегородки каждый газ
изменяет свой объем от первоначального до объема смеси, равного сумме исходных
объемов (![]() ). Изменение энтропии при смешении является суммой изменения
энтропии каждого газа при его изотермическом расширении.
). Изменение энтропии при смешении является суммой изменения
энтропии каждого газа при его изотермическом расширении. 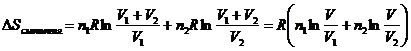 (II,24)
(II,24)