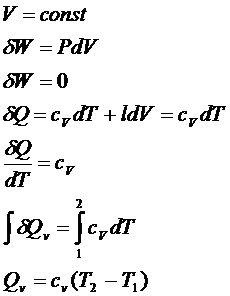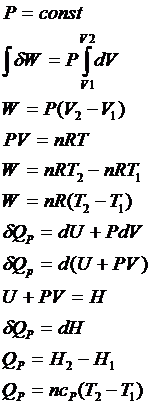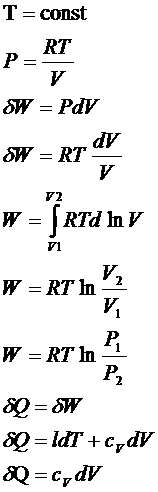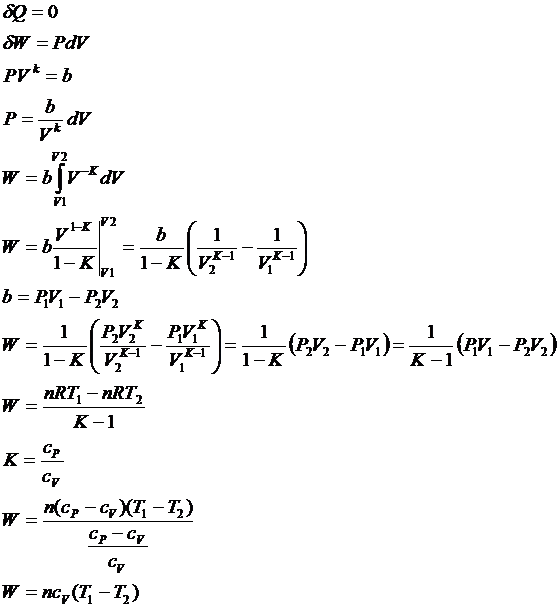1. I закон термодинамики и его аналитическое выражение.
1
закон т/д – закон сохранения энергии для процессов, связанных с работой
теплотой и внутренней энергией.
Для
круговых процессов и при постоянной температуре:
![]()
Для
некруговых процессов часть W(работы),
которая может быть подведена к системе, затрачивается на теплоту процесса и
изменение внутренней энергии системы
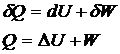
2
ур-е – интегральная форма 1-го закона т/д.
1
ур-е – дифференциальная форма
![]() -бесконечно малое количество теплоты
-бесконечно малое количество теплоты
![]() - бесконечно малое количество работы
- бесконечно малое количество работы
![]() - полный дифференциал внутренней энергии
- полный дифференциал внутренней энергии
Подведенная к системе теплота
расходуется на изменение внутренней энергии и на производство работы.
Следствия из первого закона:
1. Если
система не производит работу, то теплота расходуется на повышение внутренней
энергии:
![]()
2.
Изоэнергетический процесс:
![]()
3.
Адиабатический процесс:
![]()
Работа
совершается за счет запаса внутренней энергии.
2. Уравнение 1 закона термодинамики в
параметрах V, T и Р,Т. Физический смысл калорических коэффициентов.
В
параметрической форме уравнение первого закона термодинамики может быть составлено
в виде функционалов от пары переменных V,T Р,V P,T.
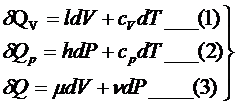 применимы для любого рабочего тела
применимы для любого рабочего тела
![]() - калорические коэффициенты
- калорические коэффициенты
Физический
смысл калорических коэффициентов из уравнений 1,2,3 можно получить, задавая постоянным
один из параметров.
Уравнение
1 Т=const
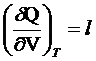
l – удельная теплота фазового превращения, определяющая
количество теплоты, которое надо подвести к единице рабочего тела, чтоб увеличить
объем на единицу при постоянной температуре. (изотермическая теплота расширения тела)
Уравнение
2 Т=const
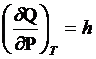
h – удельная теплота фазового превращения, определяющая
количество теплоты, которое надо подвести к единице рабочего тела, чтоб
увеличить давление на единицу при постоянной температуре. (изотермическая теплота возрастания давления)
Уравнение
1 V=const
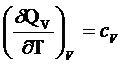
![]() - теплоемкость при V=const.
- теплоемкость при V=const.
Теплоемкость – количество теплоты, которое надо подвести к единице
массы вещества, чтоб увеличить температуру на единицу.
Уравнение
2 Р=const
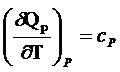
![]() - теплоемкость при Р=const.
- теплоемкость при Р=const.
3. Связь между калорическими
коэффициентами.
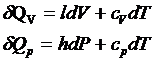
ldV+cvdT=hdP+cpdT
V=V(P,T)
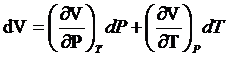
![]()
![]()
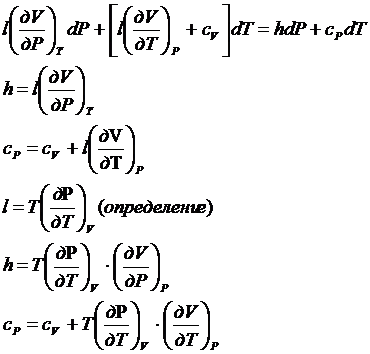
Уравнение
для калорического коэффициента h можно
упростить, если воспользоваться функцией P=P(V,T) при T=const:
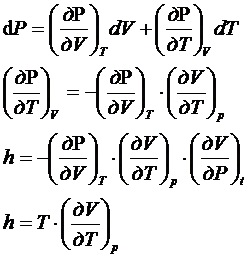
4. Вычисление теплоемкостей на основе
молекулярно-кинетической теории газов. Связь между Cv и Cp идеального
газа.
Теплоемкость отражает изменение запаса энергии в системе при
повышении температуры за счет подвода к ней определенного количества энергии в
форме теплоты.
Зависит
от:
·
Температуры (по
сложной экспоненциальной зависимости)
·
Давления
·
Природы вещества,
его состава и структуры
·
Для твердых тел –
от полиэдрической структуры
·
От свойств
рабочего тела (наиболее простые уравнения для газа в идеальном состоянии)
Газ
в идеальном состоянии – разреженный газ.
Допущения
МКТ:
·
Частицы в
заданном объеме непрерывно перемещаются с любыми скоростями – от 0 до скорости
света
·
Частицы не
взаимодействуют друг с другом, не притягиваются, не отталкиваются, соударения
частиц друг с другом соответствует соударению упругих шаров
·
Частицы в
пространстве перемещаются хаотично. Возрастает температура – возрастает энергия
движения
·
Скорость
перемещения молекул может быь определена как вектор, который можно разложить по
трем направлениям.
·
По каждому
направлению перемещается одинаковое количество вещества и это количество
вещества можно рассчитать по основному уравнению МКТ:
PV=1/3mv2 (1)
v2 – средняя квадратичная скорость
Молекулы
в газе несут кинетическую энергию:
EK=mv2/2 (2)
PV=2/3EK
Для
газа в идеальном состоянии:
PV=RT (4)
EK=3/2RT (5)
цифра
3 определяет распределение энергии по 3-м координатам, причем на каждую
координату приходится одно и то же количество энергии:
Ех=Еу=Еz=1/2RT – энергия приходящаяся на одну степень свободы.
Уравнение
5 определяет что кинетическая энергия рямо пропорциональна температуре и при
Т=0 Ек=0, т.е. при Т=0К исчезает поступательное движение молекул, но
сохраняются другие виды движения. Это условно, т.к. при Т=0К вещество не может
быть газом.
Дифференцируем
5 по Т:
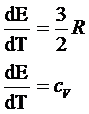
т.к.
Е=U
Cv=3/2R – Теплоемкость идеального газа при V=const
Cv=i/2R
Для
одноатомного газа i=3
Для
двухатомного - i=5
Для
трехатомного - i=7
Недостатки
МКТ:
·
При переходе от
простых к сложным молекулам теплоемкость меняется скачками
·
Теплоемкость не
зависит от V и Р, а с увеличением Т меняется
непрерывно
Связь
между Ср и Cv.
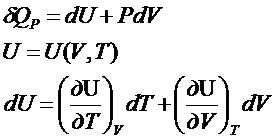
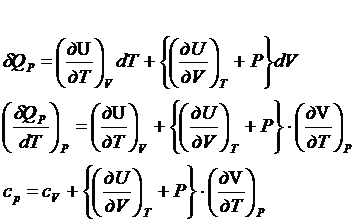
Для
газа в идеальном состоянии: ![]() =0 , тогда
=0 , тогда
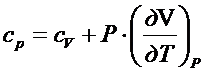
V=RT/P
dV/dT=R/P
Cp=Cv+R – закон
Майера
5. Связь между истинной и средней
теплоемкостями.
![]() -Средняя теплоемкость
-Средняя теплоемкость
С
–истинная молярная теплоемкость
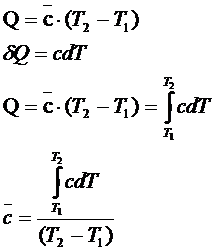
6. Зависимость внутренней энергии от V и Т для идеальных и реальных систем. Опыт
Гей-Люссака-Джоуля.
Зависимость
внутренней энергии от V и Т.
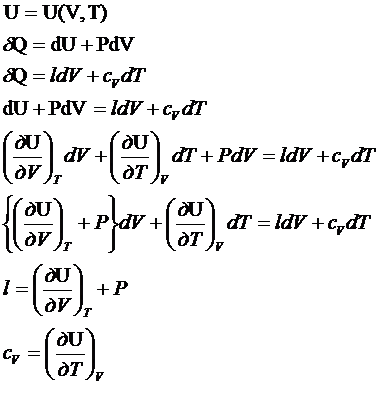
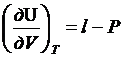 - удельная теплота
фазового перехода. Зависимость внутренней энергии от V при T=const для любого вещества в любой фазе.
- удельная теплота
фазового перехода. Зависимость внутренней энергии от V при T=const для любого вещества в любой фазе.
l-P - утреннее давление, которое развивают молекулы
в газе, жидкости или твердом теле
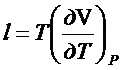
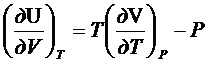 - это выражение
справедливо для идеальных и реальных газов.
- это выражение
справедливо для идеальных и реальных газов.
Для реальных газов:
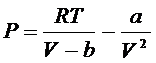 - из уравнения Ван
дер Вальса
- из уравнения Ван
дер Вальса
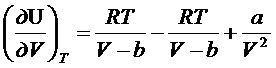
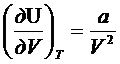 решаем дифур
решаем дифур
dU=adV/V2
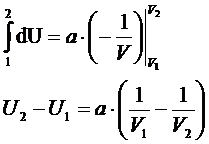
V2>>V1, значит 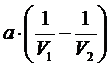 >0
>0
С
повышением объема газа, возрастает внутренняя энергия системы возрастает. Это
связано с тем, что с увеличением объема системы растет расстояние между
молекулами увеличивается, а затраты энергии на ММВ падают.
Для идеальных газов:
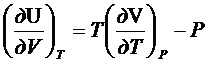
![]()
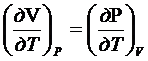

PV=RT
P=RT/V
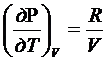
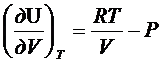 RT/V=P
RT/V=P
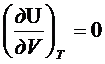 - доказательство
закона Гей-Люссака-Джоуля
- доказательство
закона Гей-Люссака-Джоуля
Опыт
Гей-Люссака-Джоуля
Внутренняя
энергия и энтальпия не зависят от P и V при Т=const для газа,
находящегося в идеальном состоянии или для разреженного газа.
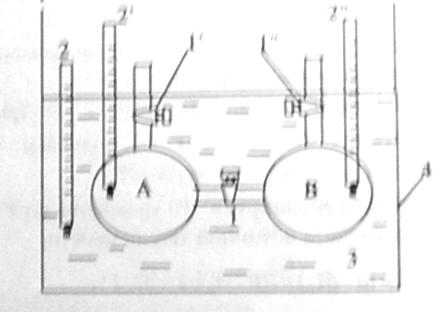 2 сосуда А и В, соединенные между собою трубкой с
краном 1, помещали в термостат 4. Сосуды снабжали отводными трубками с кранами
и термометрами. Систему приводят в равновесие, затем в левый шар накачивают Не
до 10 атм, а правый шар откачивают до 1300 Па. Систему приводят к равновесию,
отмечают температуру. Стенки шаров жесткие, V=const. Открывают
кран 1.
2 сосуда А и В, соединенные между собою трубкой с
краном 1, помещали в термостат 4. Сосуды снабжали отводными трубками с кранами
и термометрами. Систему приводят в равновесие, затем в левый шар накачивают Не
до 10 атм, а правый шар откачивают до 1300 Па. Систему приводят к равновесию,
отмечают температуру. Стенки шаров жесткие, V=const. Открывают
кран 1.
·
Не перетекает из
левого шара в правый (СМП)
·
Повышается
давление в правом шаре (НСМП)
В
левом шаре снижается температура
В
правом – возрастает
В
термостате T=const, т.к. теплоперенос в системе отсутствует.
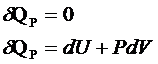
V=const => PdV=0
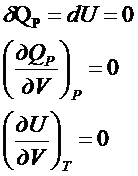
7. Аналитическое выражение энтальпии, ее
физический смысл.
Аналитическое выражение
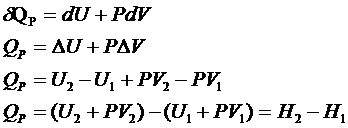
Физический смысл:
H=U+PV
dH=dU+PdV+VdP
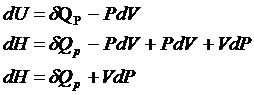
1. P=const
![]() - подведенная к системе теплота при P=const
расходуется полностью на увеличение энтальпии.
- подведенная к системе теплота при P=const
расходуется полностью на увеличение энтальпии.
2. ![]()
![]() - потенциальная работа также является источником повышения энтальпии.
- потенциальная работа также является источником повышения энтальпии.
8. Основные термодинамические процессы
расширения газа, уравнения их описывающие.
![]()